
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种微生物燃料电池(MFC)。它是一种现代化氨氮去除技术。下图为MFC碳氮联合去除的氮转化系统原理示意图。当该装置工作时,下列有关叙述正确的是

A.温度越高,该装置的转化效率越高
B.电极A上的电势比电极B上的高
C.该系统的总反应:4CH3COONH4+11O2=8CO2 +2N2+14H2O
D.MFC电池的阳极反应式为2NO3-+10e-+12H+=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应N2 ( g ) +3H2 ( g ) = 2NH3 ( g ) ,反应过程的能量变化如图所示。已知N2 ( g ) 与 H2( g )反应生成 17 gNH3(g),放出46. 1kJ的热量。请回答下列问题:
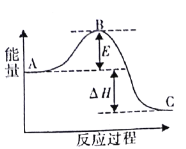
(1)该反应通常用铁作催化剂,加催化剂会使图中E_______________(填“变大”或“变小”) ,E 的大小对该反应的反应热有无影响?___________,理由是__________。
(2)图中△H=________kJ·mol -1。
(3)起始充入2mol·L-1N2和5.5mol·L-1H2,经过50min,NH3的浓度为1mol·L-1,则v(N2)=______mol·L-1·min-1,c(H2)=_____mol·L-1
(4)已知NH3(g)=NH3(l) △H=-QkJ·mol-1,则N2 ( g ) +3H2 ( g ) = 2NH3 ( l )的△H=_______kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:![]()
已知转化过程中的反应为2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是( )
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g
C. 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) 在2 L的密闭容器中进行,1分钟后,NH3减少了0.12 mol,则平均每秒钟各物质浓度变化正确的是
A.NO:0.001 mol·L-1B.H2O:0.002 mol·L-1
C.NH3:0.002 mol·L-1D.O2:0.001 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ B(g)![]() C(g) +2D(g)的能量变化如图所示,回答下列问题。
C(g) +2D(g)的能量变化如图所示,回答下列问题。

(1)该反应是_______________反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”“减小”“不变”下同),原因是__________________;
(3)向体系中加入催化剂,△H_____________;
(4)向体系中加入催化剂,反应速率增大,E1和E2的变化是E1______E2_____ ;
(5)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为___________平衡常数K=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为___,工艺师常用___(填物质名称或化学式)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作___的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是___(填化学式,下同),氧化剂是___。
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是___(填化学式,下同),氧化剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为C8H8。下列说法正确的是

A.b 的同分异构体只有 t 和 c 两种
B.t、b、c 的二氯代物均只有三种
C.t、b、c 中只有 t 的所有原子处于同一平面
D.t 和b 能使酸性 KMnO4 溶液褪色而c 不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[ Cox(OH)y(CO3)z ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
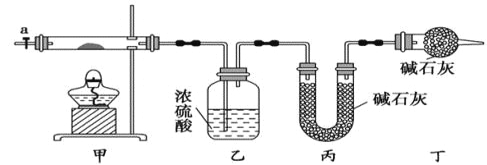
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_____________________
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填字母)连接在_________(填装置连接位置)。
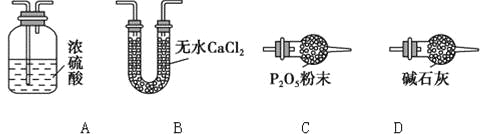
(4)若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_________________。
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为___________。
(6)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
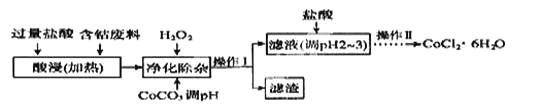
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为
③加盐酸调整PH为2~3的目的为__________________________________。
④操作Ⅱ过程为___________(填操作名称)、过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com