
����Ŀ����ʽ̼����[ Cox��OH��y(CO3)z ]���������Ӳ��ϣ����Բ��ϵ����Ӽ�������ʱ�ɷֽ��������������Ϊ��ȷ������ɣ�ij��ѧ��ȤС��ͬѧ�������ͼ��ʾװ�ý���ʵ�顣
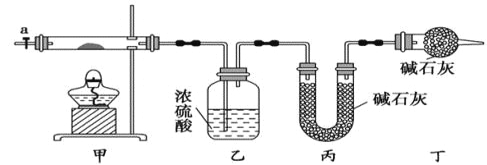
��1�����������ʵ�鲽�裺
����ȡ3.65g��Ʒ����Ӳ�ʲ������ڣ������ҡ���װ�õ�������
������ͼ��ʾװ����װ��������������װ�������ԣ�
�����ȼ��в����ܣ�����װ����____________����ʵ������ֹͣ���ȣ�
������a������ͨ����������Ӻ����ҡ���װ�õ�������
�����㡣
��2���������л���ͨ����������ӵ�Ŀ����_____________________
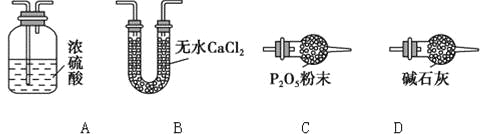
��3��ijͬѧ��Ϊ����ʵ��װ���д���һ������ȱ�ݣ�Ϊ�����һ���⣬��ѡ������װ���е�______(����ĸ)������_________(��װ������λ��)��
��4��������ȷװ�ý���ʵ�飬����������ݣ�
��װ�õ�����/g | ��װ�õ�����/g | |
����ǰ | 80.00 | 62.00 |
���Ⱥ� | 80.36 | 62.88 |
��ü�ʽ̼���ܵĻ�ѧʽΪ_________________��
��5������Co(AlO2)2�IJ���������ʵ���ҹ۲��Ԫ�ص���ɫ��Ӧ���ò�������ɫΪ___________��
��6��CoCl2��6H2O���������ˮ������Ӽ����Ժ��ܷ��ϣ�������Fe��Al�����ʣ���ȡCoCl2��6H2O��һ�ֹ������£�
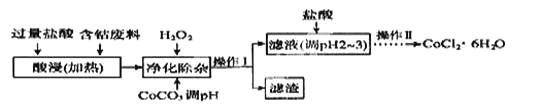
��֪��
������ | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
��ʼ������PH�� | 2.3 | 7.5 | 7.6 | 3.4 |
��ȫ������PH�� | 4.1 | 9.7 | 9.2 | 5.2 |
����������ʱ������H2O2 ������Ӧ�����ӷ���ʽΪ______________��
������CoCO3��PHΪ5.2��7.6�����������õ������ɷ�Ϊ
�����������PHΪ2��3��Ŀ��Ϊ__________________________________��
������������Ϊ___________(���������)�����ˡ�
���𰸡����������ݲ���ʱ ��װ���в�����CO2��H2O��g��ȫ�������ҡ���װ���� D ����aǰ����װ�ü�ǰ�� Co2(OH)2CO3 ��ɫ 2Fe2+��H2O2��2H��2Fe3+ ��2H2O Al(OH)3��Fe(OH)3 ����COCl2��ˮ�� ����Ũ������ȴ�ᾧ
��������
��1�����ȼ��в����ܣ�����װ���в��������ݲ���������ʽ̼���ֽܷ���ϣ�
��2��������л���ͨ����������ӣ���װ�������ɵ�CO2��H2Oȫ�������ҡ���װ���У�����Ӱ����������
��3���ڻ���aǰ����װװ��D��װ����ʢ�ŵļ�ʯ���������տ����е�ˮ�����Ͷ�����̼��
��4����ʽ̼������Ʒ3.65g����Ӧǰ��װ�õ�����Ϊ80.00g����Ӧ������Ϊ80.36g���ݴ˿��Լ�������ˮ��������Ӧǰ��װ�õ�����Ϊ62.00g����Ӧ������Ϊ62.00g���ݴ˼������������̼�������õ�Co��������Coԭ�����ʵ���������Co��H��CԪ���غ��֪�����Ƶ���ʽ̼���ܵĻ�ѧʽ��
��5������Co��A102��2�IJ���������ʵ���ҹ۲��Ԫ�ص���ɫ��Ӧ���ò���Ϊ��ɫ��������ȥ�ƹ�ĸ��ţ�
��6�����ܷ����м������ϡ���ᣬFe��Al��ϡ���ᷴӦ����FeCl2��AlCl3��CoCl2������Һ�м���˫��ˮ��CoCO3��˫��ˮ����ǿ�����ԣ��ܽ�������������Ϊ�����ӣ����ӷ�Ӧ����ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O������CoCO3��������Һ��pH��7.6��ʹFe��OH��3��Al��OH��3���ɳ�����Ȼ����ˣ�����ΪFe��OH��3��Al��OH��3����Һ�к���CoCl2��Ȼ������Һ�м���ϡ���ᣬ����CoCl2ˮ�⣬Ȼ���������Ũ������ȴ�ᾧ���˷����õ�CoCl26H2O��
��˫��ˮ���������ԣ���������ԭ�����ӣ�
�ڼ���CoCO3��pHΪ5.2��7.6�������I��õ������ɷ�ΪFe��OH��3��Al��OH��3��
��CoCl2Ϊǿ�������Σ�������ˮ�����Һ�����ԣ�����ϡ����������ˮ�⣻
�ܲ��������Ϊ����Ũ������ȴ�ᾧ�����ˡ�
��1�����ȼ��в����ܣ�����װ���в��������ݲ���������ʽ̼���ֽܷ���ϣ�
��2���������л���ͨ����������ӣ���װ�������ɵ�CO2��H2Oȫ�������ҡ���װ���У�����Ӱ����������
��3���ڻ���aǰ����װװ��D��װ����ʢ�ŵļ�ʯ���������տ����е�ˮ�����Ͷ�����̼��
��4����ʽ̼������Ʒ3.65g����Ӧǰ��װ�õ�����Ϊ80.00g����Ӧ������Ϊ80.36g��������ˮ������Ϊ80.36g-80.00g=0.36g�����ʵ���Ϊ![]() =0.02mol����Ӧǰ��װ�õ�����Ϊ62.00g����Ӧ������Ϊ62.00g�����ɶ�����̼������Ϊ62.88g-62.00g=0.88g�����ʵ���Ϊ
=0.02mol����Ӧǰ��װ�õ�����Ϊ62.00g����Ӧ������Ϊ62.00g�����ɶ�����̼������Ϊ62.88g-62.00g=0.88g�����ʵ���Ϊ![]() =0.02mol���������ܵ�����Ϊ3.65g-0.36g-0.88g=2.41g�����ʵ���Ϊ
=0.02mol���������ܵ�����Ϊ3.65g-0.36g-0.88g=2.41g�����ʵ���Ϊ![]() =0.02mol������Co��H��CԪ���غ��֪��x��y��z=0.015mol��0.02mol��2��0.02mol=2��4��2���ʼ�ʽ̼���ܵĻ�ѧʽΪCo2��OH��4��CO3��2��
=0.02mol������Co��H��CԪ���غ��֪��x��y��z=0.015mol��0.02mol��2��0.02mol=2��4��2���ʼ�ʽ̼���ܵĻ�ѧʽΪCo2��OH��4��CO3��2��
��5������Co��A102��2�IJ���������ʵ���ҹ۲��Ԫ�ص���ɫ��Ӧ���ò���Ϊ��ɫ��������ȥ�ƹ�ĸ��ţ�
��6�����ܷ����м������ϡ���ᣬFe��Al��ϡ���ᷴӦ����FeCl2��AlCl3��CoCl2������Һ�м���˫��ˮ��CoCO3��˫��ˮ����ǿ�����ԣ��ܽ�������������Ϊ�����ӣ����ӷ�Ӧ����ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O������CoCO3��������Һ��pH��7.6��ʹFe��OH��3��Al��OH��3���ɳ�����Ȼ����ˣ�����ΪFe��OH��3��Al��OH��3����Һ�к���CoCl2��Ȼ������Һ�м���ϡ���ᣬ����CoCl2ˮ�⣬Ȼ���������Ũ������ȴ�ᾧ���˷����õ�CoCl26H2O��
�ټ���H2O2�Ѷ�������������Ϊ���������ӣ�������Ӧ�����ӷ���ʽΪ2Fe2+��H2O2��2H��2Fe3+ ��2H2O��
�ڲ���1�Ƿ���Fe��OH��3��Al��OH��3��Һ��IJ������ǹ��ˣ�ǰ�����PH��Ŀ���������������Ӻ�������ת��Ϊ���������Գ����ijɷ���Fe��OH��3��Al��OH��3��
��CoCl2Ϊǿ�������Σ�������ˮ�����Һ�����ԣ�����ϡ����������ˮ�⣬���Լ���ϡ�������PHΪ2��3��Ŀ��������CoCl2ˮ�⣻
�ܲ���2�Ǵ���Һ����ȡ���ʵIJ�������������Ϊ������Ũ������ȴ�ᾧ���ˡ�


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����A��B������巢����Ӧ��aA��g��+bB(g)![]() cC(g)��ƽ��ʱ���A��Ũ��Ϊ0.5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴδﵽƽ��ʱ�����A��Ũ��Ϊ0.28mol/L�������й��ж���ȷ����
cC(g)��ƽ��ʱ���A��Ũ��Ϊ0.5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴδﵽƽ��ʱ�����A��Ũ��Ϊ0.28mol/L�������й��ж���ȷ����
A. a+b=cB. �ñ仯ʹƽ�������ƶ�
C. B��ת���ʽ���D. C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ظ���ط�(һ��������ԭ�ζ���)�ɲⶨ����Fe3O4�е�Fe2����������д������������K2Cr2O7��Fe2����Ӧ�����ӷ���ʽ_________(K2Cr2O7����ԭΪCr3��)��
��2����������Ũ��Ϊ0.010 00 mol��L��1��K2Cr2O7����Һ250 mL��Ӧȷ��ȡK2Cr2O7________ g(������λ��Ч���֣���֪M(K2Cr2O7)��294.0 g��mol��1)�����Ƹñ���Һʱ����������һ�������õ�����________��
�ٵ�����ƽ�����ձ�������Ͳ �ܲ����� ��250mL����ƿ����ͷ�ι� ��������ƽ
��3��������K2Cr2O7����Һʱ�����ӿ̶��ߣ���ⶨ���________(����ƫ��������ƫС����������������ͬ)���ζ������У����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ����ζ������____________________________��
��4����0.010 00 mol��L��1��K2Cr2O7��Һ�ζ�20.00 mLδ֪Ũ�ȵĺ�Fe2������Һ��ǡ����ȫ��Ӧʱ����10.00 mL K2Cr2O7��Һ������Һ��Fe2�������ʵ���Ũ���Ƕ��٣�_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A(g)+3B(g)![]() 4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
A. ��Ӧ����v(C)= 1mol/��L��s�� B. C��ƽ��Ũ��Ϊ4mol /L
C. A��ת����Ϊ25% D. B��ƽ��Ũ��Ϊ1.5mol /L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ǰ����������Ԫ��A��B��C��D��E��F��ԭ������֮��Ϊ107�������ǵĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�A2C�����ӻ�������е��������������һ�����Ӳ㣬E4�����Ӻ��ԭ�ӵĺ�������Ų���ͬ����ش��������⣺
��1��A��B��C��D�ĵ�һ��������С�����˳����____________����Ԫ�ط��ţ�
��2��������BD3�ķ��ӿռ乹�Ϳ�����Ϊ_________��B��ԭ�ӹ���ӻ�����Ϊ________��
��3����֪FԪ���������ں���ƫ��ʱ����Ӱ��O2�����ڵ��������䡣��֪F2����KCN��Һ��Ӧ��F��CN��2���������������KCN��Һʱ�����ܽ⣬����������F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ______��CN����___________��һ�ַ��ӣ���Ϊ�ȵ����壬��1��CN����������ĿΪ___________��
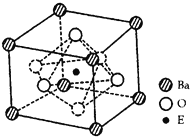
��4��EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ________
�ڸþ����У�E4��������Ϊ��Ϊ____________�����þ����߳�Ϊa nm�� ����þ�����ܶ�Ϊ__________g��cm3�������ӵ�����ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�����ˮ�д��ڵ���ƽ��D2O![]() D����OD����D2O�����ӻ�������1.0��10��12����pD����lgc(D��)�����¶����йط�����ȷ���ǣ� ��
D����OD����D2O�����ӻ�������1.0��10��12����pD����lgc(D��)�����¶����йط�����ȷ���ǣ� ��
A.0.1molNaOD������ˮ�Ƴ�1L��Һ��pD��13
B.��pD��4��DCl����ˮ��Һϡ��100����������ҺpD��6
C.pD��10��NaOD����ˮ��Һ�У�����ˮ�������c(OD��)Ϊ1��10��10mol��L��1
D.��30mL0.5mol��L��1NaOD����ˮ��Һ�м���20mL0.5mol��L��1 DCl����ˮ��Һ��������ҺpD��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����NO�Ʊ�NH4NO3�Ĺ���ԭ����ͼ��ʾ��X��Y��ΪPt�缫��Ϊʹ������ȫ��ת��ΪNH4NO3���貹������A������˵����ȷ���ǣ� ��

A.����AΪHNO3
B.X�缫Ϊ����
C.���ø�װ�õ��2molNO�����Ͽ�����1.25molNH4NO3
D.Y�缫��ӦʽΪNO��3e-��4OH-=NO3-��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܼ��仯�����Ӧ�����������ء�������Ⱦ�ϵȡ�
(1)CoO��һ���������Ӽ�����ͨ����Ӧ�٢��Ʊ���
��2Co(s)+O2(g)=2CoO(s) ��H1=akJ��mol-1
��2CoCO3(s) =CoO(s) + CO2 (g) ��H2=akJ��mol-1
��Ӧ2Co(s)+O2(g)+2CO2(g)=2CoO3(s) �Ħ�H=_________��
(2)ij﮵�صĵ���ʿɴ���Li+����ط�ӦʽΪ��LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
�ٵ�طŵ�ʱ�������ĵ缫��ӦʽΪ_________��Li+��______�ƶ��������������������
��һ�ֻ��յ缫��CoԪ�صķ����ǣ���LiCoO2��H2O2��H2SO4��Ӧ����CoSO4���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
(3)BASF��ѹ���Ʊ��������������ѭ��������ͼ-1��ʾ����ѭ�����ܷ�Ӧ����ʽΪ_________________(��Ӧ���������г�)

(4)ij���ܴ�����ͬʱ��ȥ�����ͳ�β���е�̼��(C)��NOx����ͬ�¶��£���10molģ��β�����ɷ���������ʾ������ͬ������ͨ���ô�����������в���(CO2��N2��N2O)��NO��������ݽ����ͼ-2��ʾ.
ģ��β�� | ���� | ̼�� | ||
NO | O2 | He | ||
���������������������� | 0.25% | 5% | 94.75% | a mol |

��380��ʱ������ų��������к�0.45 mol O2��0.0525 mol CO2����Y�Ļ�ѧʽΪ__________________��
��ʵ������в���NOģ��NOx,����������NO2��ԭ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ʒ�ˮ��ʹ��NaCN��������0.5 mg/L�����ɴﵽ�ŷű�����Ӧ���������С���һ��NaCN��NaClO��Ӧ������NaOCN��NaCl���ڶ���NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2����֪HCN�����ᣬ�ӷ����о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ������˵����ȷ����
A. ����NaCN�����Ʒ�ˮ�Ĺ�������Ԫ�ػ��ϼ۵ĸı�
B. ��һ����Ӧ��ҺӦ����Ϊ���ԣ��ɱ��������ж�����HCN
C. �ڶ��������ķ�ӦΪ2OCN�� + 3ClO�� ![]() 2CO2�� + CO32 + 3Cl�� + N2��
2CO2�� + CO32 + 3Cl�� + N2��
D. ����100 m3��NaCN 10.3 mg/L�ķ�ˮʵ��������Ҫ50 mol NaClO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com