
【题目】离子键、共价键、金属键、范德华力是微粒之间的不同作用力,下列物质中含有上述任意两种作用力的是( )
①Na2O2 ②SiO2 ③氦气 ④金刚石 ⑤NH4Cl ⑥白磷
A.①②④B.①③⑥C.①⑤⑥D.③④⑤
科目:高中化学 来源: 题型:
【题目】据报道,科学家最近发现了一种新原子,它的原子核内有162个中子,质量数274,该元素的核电荷数为( )
A. 112 B. 161 C. 272 D. 433
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe3O4发生的铝热反应后的生成物中,加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的离子组正确的是
A. 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+
B. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
C. 加入过量氨水:OH-、NH4+、SO42-、AlO2-
D. 加入过量铜粉:Cu2+、Fe3+、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS(s)![]() NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
A. 温度、容积不变时,通入SO2气体 B. 移走一部分NH4HS固体
C. 将容器体积缩小为原来的一半 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各项填空:
(1)AlCl3的水溶液呈_______(填“酸”、“中”或“碱”)性,常温时的pH_____7(填“>”、“<”或“=”),原因是(用离子方程式表示):_________________________;实验室在配制 AlCl3溶液时,常将 AlCl3固体先溶于浓盐酸中,然后再用蒸馏水稀释到所需的浓度,以_________(填“促进”或“抑制”)其水解。将AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是________________(填化学式)。
(2)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是___________________________________________,其原因是(以离子方程式和简要的文字说明):_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:

请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)__________________________________________________________。
(2)物质A最好使用下列物质中的____________(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在__________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH的关系图如下所示,下列说法正确的是
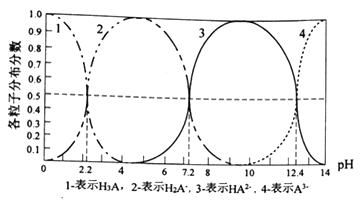
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+1/2c(HA2-)+1/3c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,c(HA2-)/c(H3A)=100.6
D. 向H3A溶液中加入氨水使pH从5→9发生的主要离子反应是:H2A-+OH-![]() HA2-+H2O
HA2-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com