
【题目】请按要求完成下列各项填空:
(1)AlCl3的水溶液呈_______(填“酸”、“中”或“碱”)性,常温时的pH_____7(填“>”、“<”或“=”),原因是(用离子方程式表示):_________________________;实验室在配制 AlCl3溶液时,常将 AlCl3固体先溶于浓盐酸中,然后再用蒸馏水稀释到所需的浓度,以_________(填“促进”或“抑制”)其水解。将AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是________________(填化学式)。
(2)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是___________________________________________,其原因是(以离子方程式和简要的文字说明):_____________________________。
【答案】酸<Al3++3H2O![]() Al(OH)3+3H+抑制Al2O3(2)有白色沉淀生成,溶液由红色变为无色Ba2++CO32-= BaCO3↓溶液为NaCl,故为中性
Al(OH)3+3H+抑制Al2O3(2)有白色沉淀生成,溶液由红色变为无色Ba2++CO32-= BaCO3↓溶液为NaCl,故为中性
【解析】
(1)氯化铝水解生成氢氧化铝和盐酸,溶液呈酸性;实验室配制氯化铝溶液时,常用浓盐酸来溶解以抑制其水解;将氯化铝溶液加热蒸干,灼烧的过程,促进了水解,最终得到氧化铝固体。
(2)纯碱溶液水解显碱性:CO32﹣+H2O![]() HCO3﹣+OH﹣,加入酚酞溶液变红;加入过量氯化钡溶液,发生了Ba2++CO32﹣=BaCO3↓反应,减小了c(CO32﹣),平衡左移,最终生成了中性氯化钠溶液,溶液红色褪去。
HCO3﹣+OH﹣,加入酚酞溶液变红;加入过量氯化钡溶液,发生了Ba2++CO32﹣=BaCO3↓反应,减小了c(CO32﹣),平衡左移,最终生成了中性氯化钠溶液,溶液红色褪去。
(1)氯化铝水解生成氢氧化铝和盐酸,溶液呈酸性,常温时pH<7;实验室配制氯化铝溶液时,为抑制氯化铝水解,将氯化铝溶于盐酸,然后加水稀释到所需浓度;将氯化铝溶液加热蒸干,促进氯化铝水解,平衡向右移动,盐酸挥发,得到氢氧化铝固体,灼烧得到氧化铝;正确答案:酸; < ;Al3++3H2O![]() Al(OH)3+3H+;抑制;Al2O3。
Al(OH)3+3H+;抑制;Al2O3。
(2)纯碱溶液存在水解平衡:CO32﹣+H2O![]() HCO3﹣+OH﹣,溶液中加入酚酞变红,加入过量氯化钡溶液发生Ba2++CO32﹣=BaCO3↓反应,产生白色沉淀,碳酸根离子浓度减小,平衡向左移动;反应生成氯化钠,溶液呈中性,红色变浅至消失;正确答案:有白色沉淀生成,溶液由红色变为无色 ;Ba2++CO32-= BaCO3↓ ;溶液为NaCl,故为中性。
HCO3﹣+OH﹣,溶液中加入酚酞变红,加入过量氯化钡溶液发生Ba2++CO32﹣=BaCO3↓反应,产生白色沉淀,碳酸根离子浓度减小,平衡向左移动;反应生成氯化钠,溶液呈中性,红色变浅至消失;正确答案:有白色沉淀生成,溶液由红色变为无色 ;Ba2++CO32-= BaCO3↓ ;溶液为NaCl,故为中性。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:

请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pb电极电解含有Cu2+和X3+均为0.1mol的溶液,阴极析出金属的质量m与溶液中通过电子的物质的量n关系如图,则离子的氧化性能力由大到小排列正确的是( )

A. Cu2+>X3+>H+ B. H+>X3+>Cu2+
C. X3+>H+>Cu2+ D. Cu2+>H+>X3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子键、共价键、金属键、范德华力是微粒之间的不同作用力,下列物质中含有上述任意两种作用力的是( )
①Na2O2 ②SiO2 ③氦气 ④金刚石 ⑤NH4Cl ⑥白磷
A.①②④B.①③⑥C.①⑤⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有下列转化关系:

(1)A、E的结构简式为:A__________________________E__________________________
(2)反应①、⑤的反应类型是①__________________⑤__________________
(3)反应③的化学方程式为:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油是混合物,汽油是纯净物
B.沸点:汽油>煤油>柴油>润滑油
C.直馏汽油和裂化汽油成分完全相同
D.石油的分馏是物理变化,而裂化和裂解属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
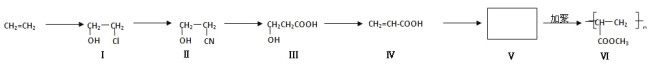
回答下列问题:
(1)化合物Ⅲ中所含官能团的名称是___________________、_______________________。
(2)化合物Ⅲ生成化合物Ⅳ的同时,副产物为____________________________。
(3)CH2=CH2与溴水反应方程式:_______________________________。
(4)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:_____________________。
(5)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是_____________。
A化合物Ⅲ可以发生氧化反应
B化合物Ⅲ不可以与NaOH 溶液反应
C化合物Ⅳ能与氢气发生加成反应
D化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气
E化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
(6)写出化合物Ⅰ与氧气在Cu催化下反应的产物______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com