
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质:
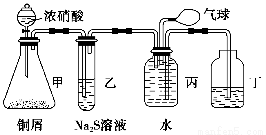
(1)写出甲中反应的离子方程式:______________________________________,乙中的现象是_____________________________________________________,可证明NO2的氧化性;在丙中鼓入空气后的现象是___________________________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是________________________________________(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是__________________________________________________________________。你认为怎样才能准确证明NO2的氧化性?________________________________________(简要回答出原理和现象即可)。
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列说法中正确的是( )。
A.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
B.某金属阳离子的结构示意图为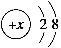 ,其与Cl-形成的强电解质都是离子化合物
,其与Cl-形成的强电解质都是离子化合物
C.二硫化碳是直线形非极性分子,其电子式为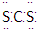
D.中子数为18的氯原子可表示为18Cl
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
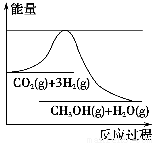
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是_________________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
下列说法正确的是 ( )。
A.金属元素和非金属元素间形成的化学键一定是离子键
B.ⅦA族元素是同周期元素中非金属性最强的元素
C.全部由非金属元素形成的化合物一定是共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
向含有下列各组离子的溶液中通入相应气体后,能大量共存的是( )。
A.通入NO2:Na+、Fe2+、Cl-、SO42-
B.通入NH3:AlO2-、NH4+、Na+、NO3-
C.通入Cl2:K+、NH4+、I-、Cl-
D.通入CO2:Na+、K+、NO3-、SiO3-
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是( )。
A.要配制100 mL 1 mol·L-1 NaOH溶液,需在白纸上称4 g NaOH固体,并且称量速度较慢
B.称量时托盘天平的砝码已被锈蚀
C.溶解或稀释溶质时烧杯尚未干燥
D.定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。
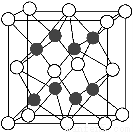
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二1-2-3元素周期表元素周期律应用练习卷(解析版) 题型:填空题
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称为__________;B在周期表中的位置是第________周期第________族。
(2)A、B形成的化合物的电子式为________。
(3)C的元素符号为________,C的最高价氧化物的化学式为____________。
(4)D的最高价氧化物对应的水化物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com