
【题目】室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液也可做缓冲溶液
【答案】D
【解析】
A.溶液a为酸性,HA电离程度大于A-水解程度,相对于纯HA,同浓度下,溶液a中存在一部分A-,起始时有了一部分产物,所以溶液a和0.1 mol/L HA溶液中HA的电离程度前者小于后者,从而H2O的电离程度前者大于后者,A选项错误;
B.根据表中数据,向溶液a中通入0.1 mol HCl时,溶液a中一共只有1L含0.1mol NaA ,则完全消耗NaA,这就超出了缓冲溶液的缓冲范围了,NaA变成了HA,溶液便失去了缓冲能力,pH不可能变化不大,B选项错误;
C.HA的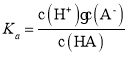 ,由表可知,1 L含0.1 mol HA和0.1 mol NaA的溶液a的pH=4.76,但此时c(A-)不等于c(HA),故该温度下HA的Ka不等于10-4.76,C选项错误;
,由表可知,1 L含0.1 mol HA和0.1 mol NaA的溶液a的pH=4.76,但此时c(A-)不等于c(HA),故该温度下HA的Ka不等于10-4.76,C选项错误;
D.向0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液中加入少量强酸或强碱,溶液的组成不会明显变化,故也可做缓冲溶液,D选项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析的描述不正确的是( )
A.图1:盐桥中使用KCl溶液,电子的流向是Zn→G→Cu→CuSO4溶液→盐桥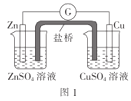
B.图2:可根据该实验验证铁的吸氧腐蚀
C.图3:在强酸和强碱的中和热实验中,强碱的浓度比强酸的略大
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断反应2NO2(g)![]() N2O4(g)是一个放热反应
N2O4(g)是一个放热反应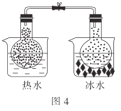
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
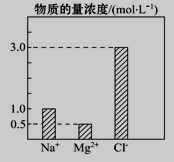
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒肺炎疫情发生以来,科学和医学界积极寻找能够治疗病毒的药物。4-去甲基表鬼臼毒素具有抗肿瘤、抗菌、抗病毒等作用,分子结构如图所示,下列说法错误的是

A.该有机物中有三种含氧官能团
B.该有机物有4个手性碳原子,且遇FeCl3溶液显紫色
C.该有机物分子中所有碳原子不可能共平面
D.1mol该有机物最多可以和2molNaOH、7molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在工业生产中应用广泛。它在催化剂作用下与水反应获取氢气的微观过程如图所示。下列说法正确的是( )
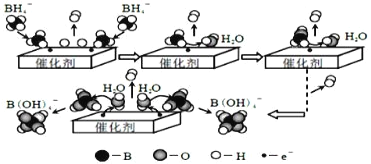
A.水在此过程中作还原剂
B.若将NaBH4中的H用D代替,反应后生成的气体中含有H2、HD和D2
C.催化剂可以加快反应速率,其用量多少不影响反应速率
D.NaBH4与水反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的D为无色黏稠液体,易溶于水,为研究D的组成与结构,进行了如下实验:
(1)称取D 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:D的相对分子质量为______。
(2)将此9.0 g D在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。则D的分子式为___________。
(3)另取D 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。实验结论:D中含有的官能团的名称是:_________、_________ 。
(4)D的核磁共振氢谱如下图:

实验结论:D的核磁共振氢谱中出现四组峰,即有不同化学环境的氢原子种数为4种,且峰面积之比为________。
(5)综上所述,D的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是( )
(丙)的分子式均为C8H8,下列说法不正确的是( )
A.甲、乙、丙在空气中燃烧时均产生明亮的火焰并伴有浓烟
B.甲、乙、丙中只有甲的所有原子可能处于同一平面
C.等物质的量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲![]() 乙
乙
D.三者中二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g)![]() Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.05 mol/(Ls)
B. 其他条件不变,增大X的浓度,平衡右移,X的转化率增大
C. 其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L
D. 其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
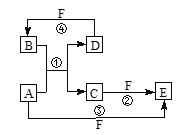
(1)若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________。已知1g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:_______________________。
(3)若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________,B固体属于____________晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com