
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
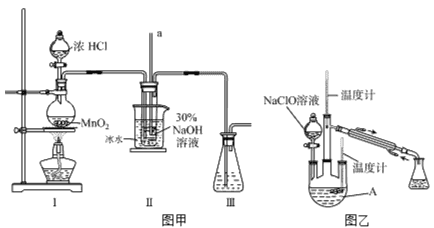
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
【答案】 BD MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
Mn2++Cl2↑+2H2O 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
【解析】I、制备 NaClO溶液
装置中:二氧化锰与浓盐酸反应制取氯气,制取的氯气中含有氯化氢,装置Ⅱ中玻璃管a的作用为平衡压强,氯气与氢氧化钠反应制备NaClO,Ⅱ中用冰水浴控制温度在30℃以下,防止NaClO (歧化)分解为氯酸钠和氯化钠,装置Ⅲ进行尾气处理。
(1)根据配制一定质量分数的溶液的步骤选用仪器;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水;
Ⅱ、制取水合肼
(3) N2H4·H2O具有强还原性,容易被过量的NaClO氧化;
(4)①碘溶液遇淀粉变蓝色,肼反应完全,再滴入碘的标准溶液后,溶液变蓝色;
②根据方程式N2H4·H2O +2I2=N2↑+4HI+H2O计算。
详解:(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,
因此,本题正确答案是:BD;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
因此,本题正确答案是:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3) N2H4·H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O,
因此,本题正确答案是:2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O;
(4)①碘的标准溶液与肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,所以选择淀粉为指示剂,
因此,本题正确答案是:淀粉溶液;
②设馏分中水合肼(N2H4·H2O)的质量分数为a,则:
N2H4·H2O +2I2=N2↑+4HI+H2O
50g 2mol
0.3000g×a 0.020L×0.15mol/L
所以50g: 0.3000g×a=2mol: 0.020L×0.15mol/L,计算得出:a=25%,
因此,本题正确答案是:25%。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】中药肉桂中含有某有机物A(分子中只含有C、H、O),其分子的球棍模型如右图所示。回答下列问题:
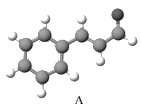
(l)写出有机物A的结构简式:__________。其分子中含有的官能团名称是__________。
(2)有机物A可由有机物M(![]() )为原料制备,转化关系如下图所示:
)为原料制备,转化关系如下图所示:

①由M生成N的反应类型是________________。
②由B生成A的反应条件是_________________。
③写出由N生成B的化学方程式:_________________。
④写出一种满足下列条件的M的同分异构体的结构简式:_________________。
a.与有机物M具有相同的官能团 b.苯环上一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法不正确的是
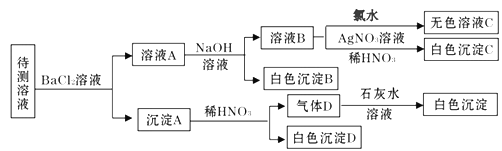
A. SO42-、SO32-至少含有一种
B. 沉淀B的化学式为 BaCO3
C. 肯定存在的离子有 Na+、CO32-、HCO3-、Cl-
D. 肯定不存在Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.Cl2在与金属反应时表现强氧化性
B.任何物质的燃烧必须有O2参与
C.Cl2与H2O反应的离子方程式为Cl2+H2O=HClO+H++Cl-
D.漂白粉的有效成分是Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
(提出猜想)
问题1:在周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性码?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性小于的Fe3+,Cu+的稳定性也小于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
(实验探究)
I. 解决问题1:
(1)实验需配制100mL 0.50mol·L-1 CuSO4溶液,除了天平、烧杯、玻璃棒、胶头滴管以外必需的玻璃仪器是______。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②_______。
II. 解决问题2的实验步骤和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80C~100C得到黑色固体粉末;继续加热至1000C以上,黑色粉末全部变成红色粉末氧化亚铜(Cu2O);
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象:
(3)写出氧化亚铜与稀硫酸反应的离子方程式____________________________。
(4)从实验中可得出的结论是:当温度在1000C以上时________(填:Cu2+或Cu+,下同)稳定,在酸性溶液中________稳定。
III. 解决问题3,某同学设计的实验如下:取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是__________________________。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因,并试图设计实验排除这种干扰。提出实验方案:向反应后的溶液中通入足量空气。试用化学反应方程式解释其原理:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
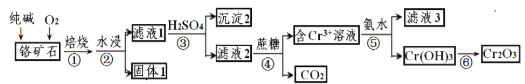
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为_________________;
(2)沉淀2的化学式为__________;
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式____________________,硫酸能否换成盐酸并说明其理由___________________;
(4)滤液3中的主要溶质是两种盐,其化学式为__________________________;
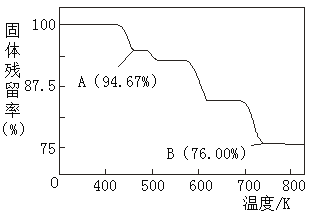
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中各有两对物质,它们都能用分液漏斗分离的是( )
A. 乙酸乙酯和饱和碳酸钠溶液,酒精和水
B. 1,1-二溴乙烷和水,硝基苯和水
C. 汽油和水,乙酸和乙醇
D. 乙酸和水,植物油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液③ 加入少量KSCN溶液
A.①②B.③②C.③①D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com