
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
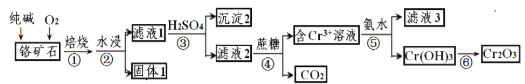
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为_________________;
(2)沉淀2的化学式为__________;
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式____________________,硫酸能否换成盐酸并说明其理由___________________;
(4)滤液3中的主要溶质是两种盐,其化学式为__________________________;
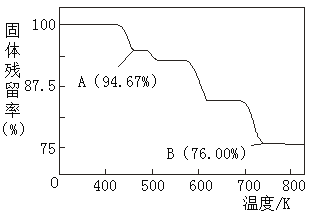
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________。
【答案】Cr(OH)3+OH-=2H2O+CrO2-H2SiO32CrO42-+2H+![]() Cr2O72-+H2O不能,HCl可能被CrO42-氧化成氯气Na2SO4 (NH4)2SO4Cr2O3
Cr2O72-+H2O不能,HCl可能被CrO42-氧化成氯气Na2SO4 (NH4)2SO4Cr2O3
【解析】
向铬矿石中加入纯碱和O2焙烧,发生反应2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2、Na2CO3+SiO2
4Na2CrO4+4CO2、Na2CO3+SiO2![]() Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4
Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4![]() Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3,据此分析回答(1)~(4)。根据Cr守恒和B点的固体残留率计算B点物质的化学式。
Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3,据此分析回答(1)~(4)。根据Cr守恒和B点的固体残留率计算B点物质的化学式。
向铬矿石中加入纯碱和O2焙烧,发生反应2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2、Na2CO3+SiO2
4Na2CrO4+4CO2、Na2CO3+SiO2![]() Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4=Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3。
Na2SiO3+CO2↑,水浸后得到的固体1的成分为Fe2O3,滤液1中含Na2CrO4、Na2SiO3;向滤液1中加入H2SO4,发生反应为Na2SiO3+H2SO4=H2SiO3↓+Na2SO4,2Na2CrO4+H2SO4=Na2Cr2O7+Na2SO4+H2O,沉淀2为H2SiO3,滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+,蔗糖被氧化成CO2;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,Cr(OH)3受热分解成Cr2O3。
(1)Cr(OH)3和Al(OH)3性质相似,Al(OH)3与KOH反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,则Cr(OH)3与KOH反应的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O。答案为:Cr(OH)3+OH-=CrO2-+2H2O
(2)根据上述分析,沉淀2的化学式为H2SiO3。
(3)步骤③中加入H2SO4将CrO42- 转化成Cr2O72-,反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O。硫酸不能换成盐酸,因为盐酸可被CrO42-氧化成Cl2。答案为:2CrO42-+2H+
Cr2O72-+H2O。硫酸不能换成盐酸,因为盐酸可被CrO42-氧化成Cl2。答案为:2CrO42-+2H+![]() Cr2O72-+H2O 盐酸可被CrO42-氧化成Cl2
Cr2O72-+H2O 盐酸可被CrO42-氧化成Cl2
(4)滤液2中含Na2Cr2O7、Na2SO4;向滤液2中加入蔗糖,蔗糖将Cr2O72-还原成Cr3+;含Cr3+的溶液中加入氨水产生Cr(OH)3沉淀,发生的离子反应为Cr3++3NH3·H2O=Cr(OH)3↓+3NH4+,滤液3中的主要溶质为Na2SO4、(NH4)2SO4。答案为:Na2SO4、(NH4)2SO4
(5)设CrO3物质的量为1mol,1molCrO3的质量为1mol×100g/mol=100g ,n(Cr)=1mol;B点固体残留率为76.00%,B点固体的质量为100g×76.00%=76g,根据Cr守恒,B点物质中n(Cr)=1mol,m(Cr)=1mol×52g/mol=52g,O的质量为76g-52g=24g,n(O)=24g÷16g/mol=1.5mol,n(Cr):n(O)=1mol:1.5mol=2:3,B点时铬的氧化物的化学式为Cr2O3。答案为:Cr2O3


科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③置换反应 ④加聚反应 ⑤取代反应
A. ①②③ B. ②④⑤ C. ①②③④⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
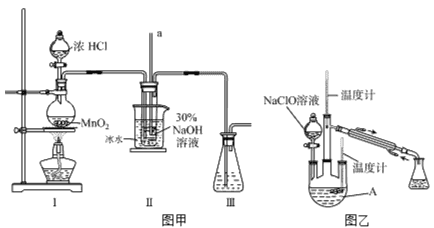
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜的冶炼方法较早的为人类掌握,人们用铜合金制造各种青铜器,古代的青铜器表面会有铜锈(碱式碳酸铜)生成,其成分可表示为:xCuCO3·yCu(OH)2·zH2O,实验室测定碱式碳酸铜成分的方法有多种。
(1)氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式_________________;
②实验装置用下列仪器连接而成:
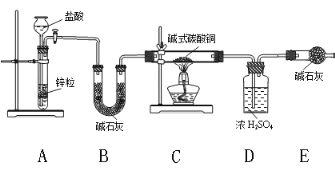
ⅰ、B装置的作用_________,装置中的一个明显缺陷,改进方法是_________________。
ⅱ、称取24 g某碱式碳酸铜样品进行试验,经数据分析处理,反应得到12.8g残留物,4.4g二氧化碳和7.2 g水。该样品中的结晶水质量为__________g,化学式为______________;
(2)某同学认为氢气还原法装置太复杂,提出简化的方法,认为可以只用C、D、E和改进后的装置直接加热碱式碳酸铜分解,你认为是否可行?请说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
①体系的压强不再改变 ②体系的温度不再改变③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ②③④⑥C. ①③④⑤D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A. 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/c(ClO3-)=1/2
B. 参加反应的氯气的物质的量等于a/2 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:![]() a mol≤ne≤
a mol≤ne≤![]() a mol
a mol
D. 改变温度,产物中KC1O3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为NA。下列叙述中正确的是 ( )
A. I L 0.1mol/L的FeCl3溶液中,H+的数目约为0.1NA
B. 1 mol金刚石中含有C-C键的数目为2NA
C. 7.8 g Na2O2中含有的阴离子数目约为0.2NA
D. 标准状况下,l L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com