
| V |
| Vm |
| 17.92L |
| 22.4L/mol |
|
|


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、少量SO2通入NaOH 溶液中:OH-+SO2→HSO3- |
| B、H2S 通入氯水中:S2-+Cl2→S↓+2Cl- |
| C、二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO↑ |
| D、H2SO4 与Ba(OH)2 溶液反应:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(H2)/mol | 0.11 | 0.09 | 0.07 | 0.07 |
| A、反应前2min的平均速率υ(H2)=0.0075mol/(L?min) |
| B、其他条件不变,升高温度,反应达到新平衡前υ(正)>υ(逆) |
| C、其他条件不变,充入0.2molH2,再次达到平衡时,CH3OH的体积分数增大 |
| D、第2~4min、第4~7min,H2的平均速率:υ(2~4)=υ(4~7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
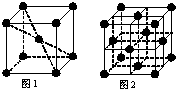
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D、测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.72L |
| B、13.44L |
| C、15.68L |
| D、22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com