
【题目】氮化碳结构如图,其中 β—氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是
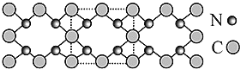
A. 氮化碳属于原子晶体
B. 氮化碳中 C 为-4 价,N 为+3 价
C. 氮化碳的化学式为 C3N4
D. 晶体中原子最外层都达 8 电子结构
【答案】B
【解析】
A.根据原子晶体的结构和性质分析;
B.氮元素的电负性大于碳元素,在氮化碳中氮元素显负价,碳元素显正价;
C.利用均摊法确定其化学式;
D.根据图片判断碳原子和氮原子的连接方式.
A.由题给信息,氮和碳以共价键结合,又氮化硅是超硬新材料,符合原子晶体的典型物理性质,故A正确;
B.氮元素的电负性大于碳元素,在氮化碳中氮元素显-3价,碳元素显+4价,故B错误;
C.晶体结构模型中虚线部分是晶体的最小结构单元,正方形的顶点的原子占1/4,边上的原子占1/2,C:4×1/4+4×1/2=3,N:4,晶体的化学式为C3N4,故C正确;
D.根据图知,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,均达到8电子稳定结构,故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】煤矸石是采煤过程和洗煤过程中排放的固体废物,其主要成分是Al2O3、SiO2,此外还含有FeO、Fe2O3等杂质。煤矸石经处理后,可用于制备铵明矾等。
已知:i.SiO2不与硫酸反应;Al2O3能与H2SO4反应。
ii.Fe3+、Fe2+、Al3+开始沉淀、完全沉淀的pH如表所示。
Fe2+ | Fe3+ | Al3+ | |
开始沉淀的pH | 6.3 | 1.5 | 3.4 |
完全沉淀的pH | 8.3 | 2.8 | 4.7 |
iii.NH4Al(SO4)2·12H2O的摩尔质量为453g·mol-1。
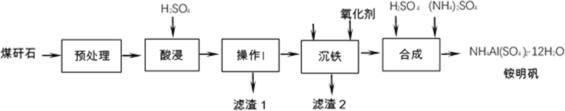
(1)酸浸过程中,Fe2O3与硫酸反应的离子方程式为___________
(2)下列说法中,正确的是___________(填字母)。
a.预处理时,粉碎煤矸石有利于提高酸浸反应速率 b.操作I是过滤 c.滤渣1中一定含有硅元素
(3)沉铁过程中,加入氧化剂的作用是___________
(4)制备过程中,若需检验滤渣1中含有![]() ,实验方案为:取少量滤渣1的洗涤液,向其中加入___________(填试剂和现象),说明其中含有
,实验方案为:取少量滤渣1的洗涤液,向其中加入___________(填试剂和现象),说明其中含有![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜常用作有机合成催化剂,难溶于水,不溶于稀硝酸和乙醇,但可溶于Cl-浓度较大的体系生成配离子[CuCl2]-,在潮湿空气中易水解氧化为碱式氯化铜。一种制备CuCl的流程如图,下列说法不正确的是

A.X试剂可选用乙醇
B.操作④可在真空中进行
C.流程中可循环利用的物质有两种
D.用去氧水稀释目的是使[CuCl2]-转化为CuCl,同时防止CuCl 被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______,A与新制氢氧化铜悬浊液反应的化学方程式为_______。
(2)C的结构简式为________,D与E之间的关系为_______。
(3)反应⑦的反应类型为_______;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
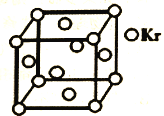
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验一 碘含量的测定
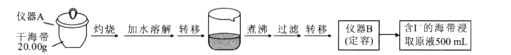
取0.0100 mol/L的 AgNO3标准溶液装入滴定管,取100.00 mL 海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
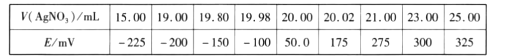
回答下列问题:
(1)实验中“灼烧”是在___________(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__________________________________
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为___________mL,计算得海带中碘的质量百分含量为_______________________%。
实验二 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
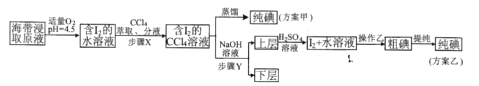
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)“适量O2”中能代替O2的最佳物质对应的电子式为_________________
(5)若要测定“I2+水溶液”中碘的含量,可以选择______________作指示剂,用 Na2S2O3溶液滴定,滴定终点的现象是____________________。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为_________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
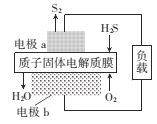
![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列粒子的空间构型
(1)CO2:_______________________
(2)H2S:____________
(3)SO2:___________
(4)NH4+:_________________
(5)CO32-:_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com