
下列关于Na2O2的叙述不正确的是( )
A.1 mol Na2O2与足量CO2反应转移的电子为1 mol
B.将10 g H2和CO的混合气体充分燃烧,将生成物(H2O、CO2)通入足量的Na2O2固体中充分反应,固体增重为10 g
C.将Na2O2投入FeSO4溶液中生成红褐色沉淀
D.将等物质的量的NaHCO3和Na2O2混合后,在密闭容器中充分加热排除气体后剩余固体为Na2CO3
D
【解析】
试题分析:过氧化钠与水的反应中,既是氧化剂,也是还原剂,1 mol Na2O2与足量CO2反应转移的电子为1 mol,A正确;氢气和CO燃烧生成水和CO2,生成的水和CO2又和过氧化钠反应生成氧气,所以固体增加的质量就是氢气和CO的质量,B正确;过氧化钠具有强氧化性,能把硫酸亚铁氧化生成硫酸铁,进而生成氢氧化铁红褐色沉淀,C正确;NaHCO3与Na2O2混合,在密闭容器中充分加热,碳酸氢钠固体加热反应方程式为2NaHCO3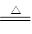 Na2CO3+CO2↑+H2O,所产生的气体CO2、H2O分别与Na2O2的反应,方程式是2CO2+2Na2O2=2Na2CO3+O2↑,2H2O+2Na2O2=4NaOH+O2↑。由于NaHCO3和Na2O2的物质的量相等,所以含有后生成物恰好是碳酸钠后氢氧化钠,D不正确,答案选D。
Na2CO3+CO2↑+H2O,所产生的气体CO2、H2O分别与Na2O2的反应,方程式是2CO2+2Na2O2=2Na2CO3+O2↑,2H2O+2Na2O2=4NaOH+O2↑。由于NaHCO3和Na2O2的物质的量相等,所以含有后生成物恰好是碳酸钠后氢氧化钠,D不正确,答案选D。
考点:考查过氧化钠的性质
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,对学生的思维能力要求高。有利于激发学生的学习兴趣,有利于培养学生的逻辑思维能力和发散思维能力。该题的难点是选项D,注意在过氧化钠不足的情况下,明确与水和CO2反应的先后顺序。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2晶体中阴阳离子个数之比为1:1 | B、Na2O2晶体中既有离子键又有非极性共价键 | C、Na2O2在空气中加热可以得到更稳定的Na2O | D、Na2O2长期露置于空气中最终转变成NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2中阴、阳离子的个数比为1:2 | B、Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | C、Na2O2与Na2O均是碱性氧化物 | D、Na2O2能漂白所有有色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种淡黄色固体 | B、能与水反应放出臭氧 | C、Na在空气中点燃可制得Na2O2 | D、能用来漂白物质、作供氧剂等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na2O2的叙述正确的是 ( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只作氧化剂
C.用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色
D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com