
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
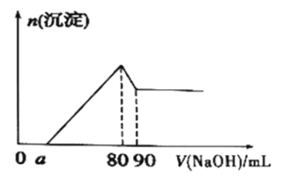
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
【答案】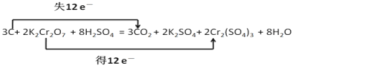 K2Cr2O7 C C 4.48L B B
K2Cr2O7 C C 4.48L B B
【解析】
(1)该反应中中C元素的化合由0升高为+4价,Cr元素的化合价由+6价降低为+3价,该反应转移12e-,则用双线桥法标出电子转移方向和数目为 ;
;
(2)氧化剂得电子化合价降低,所以K2Cr2O7为氧化剂;被氧化的元素化合价应升高,所以C元素被氧化;
(3)该反应中硫酸反应生成盐和水,所以表现酸性,所以选C;
(4)根据双线桥可知转移0.8mol电子时生成二氧化碳的物质的量为0.2mol,标况下体积为4.48L;
(5)A.将1molCl2通入到含1molFeI2溶液中,氯气量不足,碘离子还原性强于二价铁离子,氯气先氧化碘离子,离子方程式:2I-+Cl2=2Cl-+I2,故A错误;
B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合反应方程式为:2AlO2-+5H+=Al3++Al(OH)3↓+2H2O,1mol偏铝酸根离子消耗1mol氢离子生成1mol氢氧化铝沉淀,剩余的1.5mol氢离子溶解0.5mol氢氧化铝沉淀,则AlO2-与Al(OH)3消耗的H+的物质的量之比为1mol:1.5mol=2:3,故B正确;
C.过量SO2通入到NaClO溶液中,SO32-有强还原性,ClO-有强氧化性,发生氧化还原反应,正确的离子方程式为:SO2+H2O+ClO-=2H++SO42-+Cl-,故C错误;
D.Ca(HCO3)2溶液与足量的NaOH溶液反应,离子方程式:Ca2++2HCO3-+OH-=CaCO3↓+2H2O+CO32-,故D错误;
综上所述选B;
(6)A.滴加80mLNaOH溶液时沉淀量达到最大,此时沉淀为Al(OH)3和Mg(OH)2,溶液中的溶质为NaCl,则n(HCl)=n(Cl-)=n(Na+)=0.08L×1mol/L=0.08mol,HCl溶液的浓度为1mol/L,所以HCl溶液的体积为80mL,故A错误;
B.80~90mL发生反应Al(OH)3+OH-=AlO2-+2H2O,根据元素守恒可知n(Al)=0.01L×1mol/L=0.01mol,故B正确;
C.根据已知条件无法确定Mg的量,则无法确定金属溶解时消耗的HCl的量,所以产生H2的物质的量不确定,故C错误;
D.a~80mL发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,铝离子消耗的NaOH的体积为![]() =0.03L=30mL,a=20,则镁离子消耗的NaOH的体积为80mL-20mL-30mL=30mL,所以n(Mg)=0.03L×1mol/L×
=0.03L=30mL,a=20,则镁离子消耗的NaOH的体积为80mL-20mL-30mL=30mL,所以n(Mg)=0.03L×1mol/L×![]() =0.015mol,故D错误;
=0.015mol,故D错误;
综上所述选B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】1mol不饱和烃A可以和1molCl2发生加成反应,生成2–甲基–2,3–二氯戊烷。
(1)不饱和烃A结构简式____;
(2)满足下列条件B的结构简式和名称分别为____、____(填一种)。
①与A互为同分异构体
②能使溴水褪色
③核磁共振氢谱有五个峰,峰面积之比是3﹕3﹕3﹕2﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
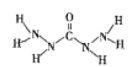
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 三种元素的原子具有相同的电子层数,
三种元素的原子具有相同的电子层数,![]() 原子的核电荷数比
原子的核电荷数比![]() 原子的核电荷数大2,
原子的核电荷数大2,![]() 原子的电子总数比
原子的电子总数比![]() 原子的电子总数大4;
原子的电子总数大4;![]() 单质
单质![]() 与足量
与足量![]() 溶液反应可生成
溶液反应可生成![]() (标准状况下)氢气,此时
(标准状况下)氢气,此时![]() 转化为与氖原子具有相同电子层结构的离子。
转化为与氖原子具有相同电子层结构的离子。
(1)写出各元素的名称:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)写出![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的简单氢化物的水溶液反应的离子方程式:____________。
的简单氢化物的水溶液反应的离子方程式:____________。
(3)![]() 形成的简单离子的氧化性比
形成的简单离子的氧化性比![]() 形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.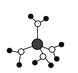 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.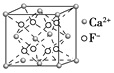 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
A. 增加C的量
B. 将容器的体积减小一半
C. 保持体积不变,充入氮气使体系的压强增大
D. 保持压强不变,充入氮气使体系的体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且都位于第四周期,原子序数A<B<C。A、C核外均没有未成对电子,C位于ds区;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布图为__;D和E的电负性大小关系为__(用元素符号表示)。
(2)化合物E2D分子的空间构型为__,中心原子采用_杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_,任意写出一种它的等电子体的化学式为_。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l36.4℃。则该化合物晶体内含有的作用力类型有_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。

①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
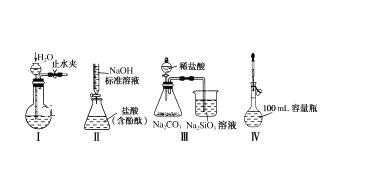
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com