
| A. | NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H1 | |
| B. | NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H4 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq )+H2O(l);△H2 | |
| D. | CH3COOH(aq)+NaOH(aq)═CH3COONa (aq )+H2O(l);△H3 |
分析 酸碱中和反应为放热反应,放出热量越大,则焓变值越小;浓硫酸溶于水放热、醋酸电离时放热,据此进行判断各焓变大小.
解答 解:A.NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1;氢氧化钠与稀硫酸的反应为稀的强酸与强碱的中和反应;
B.NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H4;浓硫酸溶于水放出热量,则该反应中放出热量增大,放出热量越大,焓变值越小,则焓变△H4<△H1;
C.NaOH(aq)+HCl(aq)═NaCl(aq )+H2O(l)△H2;氢氧化钠与盐酸的反应为稀的强酸与强碱的反应,则△H1=△H2;
D.CH3COOH(aq)+NaOH(aq)═CH3COONa (aq )+H2O(l)△H3;醋酸为弱酸,电离过程吸收热量,则该反应放出热量减小,其焓变值最大;
根据分析可知,焓变值大小为:△H4<△H1=△H2<△H3,
故选D.
点评 本题考查了反应热大小比较,题目难度不大,明确化学反应与能力变化的关系为解答关键,注意放热反应中,放出热量越大,焓变值越小,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不跟任何酸起反应 | |
| B. | 二氧化硅的化学键是共价键,可溶于水制得硅酸 | |
| C. | 根据CO2通入水玻璃中可制得硅酸,可知碳酸的酸性比硅酸强 | |
| D. | 硅在常温下能跟氢气起反应生成SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(m+N)mol | B. | $\frac{a}{A+2m}$ (A-N+m)mol | C. | $\frac{a}{A+m}$(A-N+m)mol | D. | $\frac{a}{A+2m}$(m+N)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 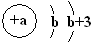 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物受热易分解 | |
| B. | 该元素是植物生长所需要的一种营养元素 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 最高价氧化物对应的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的酸性强于硫化氢 | |
| B. | 氯化氢的稳定性比硫化氢强 | |
| C. | 氯气能与水反应而硫不能 | |
| D. | 氯原子最外电子层上有7个电子而硫最外电子层上有6个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com