
【题目】Ⅰ.某校化学课外活动小组进行测定果汁中维生素C(分子式是C6H8O6)含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
(1)实验目的:测定××牌软包装鲜橙汁维生素C含量。
(2)实验原理:C6H8O6+I2→C6H6O6+2H++2I-
(3)实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3molL-1的标准碘(水)溶液,指示剂,蒸馏水等。
(4)实验过程:
①洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,用标准液润洗的仪器是______________________。
②打开橙汁包,目测:颜色―橙黄色,澄清度―好,将酸式滴定管用橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是___________________________。
③用左手操作滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化。滴定至终点时的现象是
___________________________________________________________________。
(5)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是__________________mg·L-1。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果
_________________。(填“偏高”“偏低”或“无影响”)。
Ⅱ.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
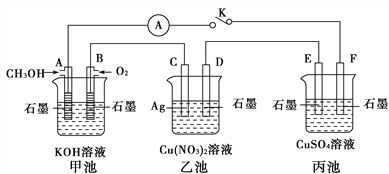
请回答下列问题:
(1)甲池为__________(填“原电池”“电解池”),A电极的电极反应式为_________________________
(2)丙池中F电极为_____________(填“正极”“负极”“阴极”或“阳极”),该池的总反应方程式为
____________________________________________________________
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使乙池恢复到反应前浓度的是_________(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
【答案】 酸式滴定管 淀粉溶液 溶液变为蓝色,且半分钟不褪色 1320 偏低 原电池 CH3OH+8OH--6e-===CO32-+6H2O 阴极 2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑ 560 B
2H2SO4+2Cu+O2↑ 560 B
【解析】Ⅰ、(4)①用标准液润洗的仪器是酸式滴定管;②由于碘能使淀粉变蓝色,所以,指示剂应选用淀粉试液;③滴定至终点时的现象是溶液变蓝色半分钟不褪色;(5)在实验中消耗的标准碘溶液的体积应该是20ml,20ml标准碘溶液碘中含有碘的物质的量为:0.020L×7.50×10-3mol/L=1.5×10-4mol,质量为1.5×10-4mol×254g/mol=3.81×10-2g=38.1mg,设20.0mL待测橙汁中维生素C的质量为X,则
C6H8O6 + I2→C6H6O6+2H++2I-
176 254
x 38.1mg
因此有![]() =
=![]() ,解得:x=26.4mg,则1L中含维生素C的质量为:26.4mg×1000ml/20ml=1320mg,所以,则此橙汁中维生素C的含量是1320mg/L;
,解得:x=26.4mg,则1L中含维生素C的质量为:26.4mg×1000ml/20ml=1320mg,所以,则此橙汁中维生素C的含量是1320mg/L;
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,导致标准溶液的体积偏小,则滴定结果偏低;
Ⅱ、(1)甲、乙、丙三池中只有甲池中的氧化还原反应能自发进行,因此甲池为原电池。A电极通入甲醇是负极,电解质溶液显碱性,则负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;(2)丙池中F电极与甲池负极相连,为阴极,丙池为电解硫酸铜溶液,总反应式为2CuSO4+2H2O ![]() 2H2SO4+2Cu+O2↑。(3)乙池中C电极是阳极,电极反应式为Ag-e-=Ag+,甲池中B电极反应式为2H2O+O2+4e-=4OH-,则有关系式:4 Ag~O2,故V(O2)=
2H2SO4+2Cu+O2↑。(3)乙池中C电极是阳极,电极反应式为Ag-e-=Ag+,甲池中B电极反应式为2H2O+O2+4e-=4OH-,则有关系式:4 Ag~O2,故V(O2)=![]() ×
×![]() ×22.4L/mol=0.56 L=560mL。(4)从丙池的电解总反应式可以看出,溶液中减少的“2Cu+O2”相当于CuO,因此可以加入CuO或CuCO3,答案选B。
×22.4L/mol=0.56 L=560mL。(4)从丙池的电解总反应式可以看出,溶液中减少的“2Cu+O2”相当于CuO,因此可以加入CuO或CuCO3,答案选B。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
②增大压强可加快SO2转化为SO3的速率
③黄绿色的氯水光照后颜色变浅
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
⑤对平衡体系H2(g)+I2(g) ![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
A. ①③④ B. ②⑤ C. ①⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
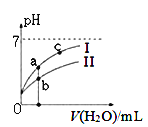
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式CO32-+ 2H+ = H2O + CO2↑中的CO32-代表的物质可以是
A.CaCO3 B.NaHCO3 C.Na2CO3 D.BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。
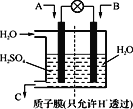
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
A. CO2和SO2B. CH4和H2SC. BF3和NH3D. HCl和HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com