
【题目】下列各项操作中,会产生“先沉淀后溶解”现象的是
A.向![]() 溶液中通入过量
溶液中通入过量![]() B.向
B.向![]() 溶液中加入足量金属钠
溶液中加入足量金属钠
C.向![]() 溶液中滴入过量盐酸D.向沸水中滴加饱和
溶液中滴入过量盐酸D.向沸水中滴加饱和![]() 溶液
溶液
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
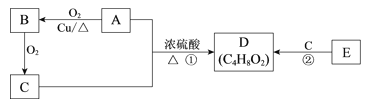
【题目】常见有机物 A、B、C、D、E的相互转化关系如下图。已知D 是有香味且不易溶于水的油状液体,E的产量可以用来衡量一个国家的石油化工发展水平。
请回答:
(1)A中含有的官能团名称是___________。
(2)B的结构简式是___________。
(3)①的化学方程式是__________________。
(4)下列说法正确的是______。
a.E分子中所有原子在同一平面上
b.用饱和Na2CO3溶液除去D中混有的C
c.②的反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国药学家屠哟哟因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖。青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )
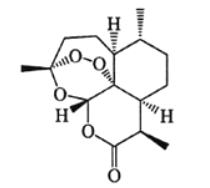
A.可使用质谱仪测出这个分子的相对分子质量,也可用紫外光谱确定这个分子的环状结构
B.提取过程中为防止破坏青蒿素结构,应避免高温,故采用低沸点溶剂乙酸进行萃取
C.青蒿素是脂溶性的,既可看作是醚类也可看作是酯类,既有氧化性又有还原性
D.元素分析仪可以确定青蒿素中是否含有C、H、O等元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子组成表示为CxHy的烷、烯、炔烃说法不正确的是( )
A.当x≤4时,均为气体(常温常压下)
B.y一定是偶数
C.分别燃烧1mol,消耗氧气(x+![]() )mol
)mol
D.在容积固定密闭容器中完全燃烧,反应前后均150℃时测得的压强一定是反应后大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是目前使用最广泛的白色颜料。工业上,以钛铁矿(主要成分为钛酸亚铁[FeTiO3],含有少量SiO2杂质)为原料制备二氧化钛的过程如下图所示。
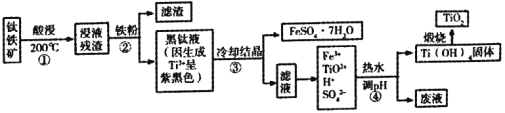
已知:①超过70℃TiO2+易水解;低于0℃ FeSO4·7H2O大量结晶。
②钛的化合价主要有+4价和+3价,其中Ti3+(紫黑色)还原性比Fe2+强
③有关氢氧化物开始沉淀的pH如下:
氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀时的pH | 0.5 | 3.0 | 1.5 | 7.6 |
根据相关信息回答下列问题;
(1)酸浸过程选用的酸是__________。
(2)步骤①中生成Fe2+和TiO2+的化学反应方程式为__________。
(3)以下相关描述正确的是__________。
A 步骤②中加入铁粉,在防止Fe2+转化成Fe3+的同时也将部分TiO2+氧化成了Ti3+
B 步骤③中的降温结晶过程可以选择冰水混合物
C ③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+
D 废液成分中有硫酸,可以循环利用
(4)步④中生成Ti(OH)4的离子方程式为__________,选择的pH范围是__________。
(5)证明步骤④中Ti (OH)4固体已经洗涤干净的方法是__________。
(6)钛酸锂(Li4Ti5O12)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示。下列有关叙述正确的是( )
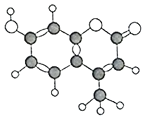
①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5mol H2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3mol Br2
⑦该物质遇FeCl3溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应
A.①②④⑥B.②④⑤⑥C.②④⑦⑧D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 是石油裂解气的主要成分之一,以 A 为原料制备药物中间体 X 的合成路线如下:

已知: i 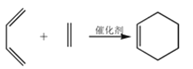 ii
ii ![]()
回答下列问题:
(1)D 中含碳原子的官能团的结构简式为_____。
(2)有机物 I 的结构简式为_____;反应④的反应类型是________。
(3)反应⑥的化学方程式为_____。
(4)根据已知条件写出 CH2=CH—CH=CH2 与有机物 G 的化学反应方程式_____; 该产物发生反应③后得到的有机物其核磁共振氢谱中有_____组峰。
(5)满足以下条件的 I 的同分异构体有_____种。
i 官能团的类型与 I 不同; ii 含有六元环结构; iii 六元环上只有 1 个取代基。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com