
【题目】二氧化钛是目前使用最广泛的白色颜料。工业上,以钛铁矿(主要成分为钛酸亚铁[FeTiO3],含有少量SiO2杂质)为原料制备二氧化钛的过程如下图所示。
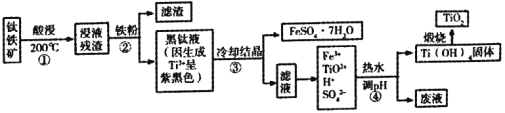
已知:①超过70℃TiO2+易水解;低于0℃ FeSO4·7H2O大量结晶。
②钛的化合价主要有+4价和+3价,其中Ti3+(紫黑色)还原性比Fe2+强
③有关氢氧化物开始沉淀的pH如下:
氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀时的pH | 0.5 | 3.0 | 1.5 | 7.6 |
根据相关信息回答下列问题;
(1)酸浸过程选用的酸是__________。
(2)步骤①中生成Fe2+和TiO2+的化学反应方程式为__________。
(3)以下相关描述正确的是__________。
A 步骤②中加入铁粉,在防止Fe2+转化成Fe3+的同时也将部分TiO2+氧化成了Ti3+
B 步骤③中的降温结晶过程可以选择冰水混合物
C ③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+
D 废液成分中有硫酸,可以循环利用
(4)步④中生成Ti(OH)4的离子方程式为__________,选择的pH范围是__________。
(5)证明步骤④中Ti (OH)4固体已经洗涤干净的方法是__________。
(6)钛酸锂(Li4Ti5O12)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极反应式为__________。
【答案】硫酸或浓硫酸 FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O CD TiO2++3H2O![]() Ti(OH)4↓+2H+(条件>70℃) 0.5-1.5 取少量最后一次洗涤液于试管中,加入几滴KSCN溶液,若溶液不变红,证明沉淀已洗净(或取少量最后一次洗涤液于试管中,加入少量BaCl2溶液,若无白色沉淀,证明沉淀已洗净) LiXO2 - ae-→ Li1-aXO2 + aLi+
Ti(OH)4↓+2H+(条件>70℃) 0.5-1.5 取少量最后一次洗涤液于试管中,加入几滴KSCN溶液,若溶液不变红,证明沉淀已洗净(或取少量最后一次洗涤液于试管中,加入少量BaCl2溶液,若无白色沉淀,证明沉淀已洗净) LiXO2 - ae-→ Li1-aXO2 + aLi+
【解析】
流程第①步加酸溶解生成TiO2+和Fe2+,第②步加铁粉还原Fe3+,过滤除去滤渣,第③步冷却结晶,过滤得到FeSO4·7H2O和含有TiO2+的溶液;第④步调节PH,使TiO2+水解生成Ti(OH)4,过滤得到Ti(OH)4;第⑤步Ti(OH)4受热分解生成化生成TiO2.
(1)③步冷却结晶,过滤得到FeSO4·7H2O,酸浸过程选用的酸是硫酸或浓硫酸。
(2)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O,则步骤①中生成Fe2+和TiO2+化学反应方程式为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(3)A 、步骤②中加入铁粉,亚铁离子易被氧化,则加入铁粉的主要目的是将Fe3+转化为Fe2+并防止Fe2+被氧化,故A不选;
B、 步骤③中的降温结晶过程可以选择冰水混合物
C 、由流程图中经过反应③后形成FeSO4·7H2O沉淀,滤液中有Fe2+、TiO2+、H+,③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+,故C选;
D 、TiO2+在一定条件下会发生水解生成Ti(OH)4和氢离子,溶液中存在平衡:TiO2++3H2O ![]() Ti(OH)4+2H+,废液成分中有硫酸,可以循环利用,故D选;
Ti(OH)4+2H+,废液成分中有硫酸,可以循环利用,故D选;
故选CD。
(4)步④中生成Ti(OH)4的离子方程式为TiO2++3H2O![]() Ti(OH)4↓+2H+(条件>70℃),Ti(OH)4沉淀而Fe(OH)3不沉淀,选择的pH范围是0.5-1.5。
Ti(OH)4↓+2H+(条件>70℃),Ti(OH)4沉淀而Fe(OH)3不沉淀,选择的pH范围是0.5-1.5。
(5)Ti(OH)4沉淀后滤液中有Fe3+ 、SO42-,证明步骤④中Ti (OH)4固体已经洗涤干净的方法是:取少量最后一次洗涤液于试管中,加入几滴KSCN溶液,若溶液不变红,证明沉淀已洗净(或取少量最后一次洗涤液于试管中,加入少量BaCl2溶液,若无白色沉淀,证明沉淀已洗净) 。
(6)新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极LiXO2失电子,发生氧化反应,电极反应式为LiXO2 - ae-→ Li1-aXO2 + aLi+。


科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。请回答下列问题:
(1)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应。
①下列描述能说明该可逆反应达到化学平衡状态的有__。
A.容器内气体的密度不变
B.c(N2):c(H2):c(NH3)=1:3:2
C.容器内的压强不变
D.相同时间内有3molH-H键断裂,有6molN-H键形成
E.3v正(H2)=2v逆(NH3)
F.容器内气体的平均相对分子质量不变
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可采用的方法__(一种即可)。
(2)一定温度下,2L密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=__,该温度下反应的化学平衡常数数值为__。
②升高温度时,气体颜色加深,则正反应是__(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40mo1NO2,则达到平衡后:c(NO2)__0.15mol/L(填“>”、“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是![]() 表示阿伏加德罗常数
表示阿伏加德罗常数![]()
A.18g水在标准状况下的体积约为![]()
B.在标准状况下,![]() 氮气中含有
氮气中含有![]() 个氮原子
个氮原子
C.![]() 中含有的原子总数目为
中含有的原子总数目为![]()
D.80gNaOH溶解在1L水中,得到溶液的物质的量浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:

下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,会产生“先沉淀后溶解”现象的是
A.向![]() 溶液中通入过量
溶液中通入过量![]() B.向
B.向![]() 溶液中加入足量金属钠
溶液中加入足量金属钠
C.向![]() 溶液中滴入过量盐酸D.向沸水中滴加饱和
溶液中滴入过量盐酸D.向沸水中滴加饱和![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是![]()
A.![]() 个
个![]() 胶体粒子的质量为78g
胶体粒子的质量为78g
B.![]() g
g![]() 和CuO的混合物中含有铜原子数为
和CuO的混合物中含有铜原子数为![]()
C.在![]() 的碳酸钠溶液中,阴离子总数一定大于
的碳酸钠溶液中,阴离子总数一定大于![]()
D.标准状况下,![]() L己烷中共价键数目为
L己烷中共价键数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
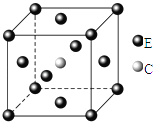
(1)B2A4分子中B原子轨道的杂化类型为________,B2A4分子中σ键和π键个数比为________
(2)A、B、C、D四种元素的电负性从大到小的顺序为________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是________
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是________
(4)元素E能形成多种配合物,如:E(CO)5等.
①基态E原子的价电子排布式为________.
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于________(填晶体类型),该晶体中E的化合价为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求完成下列问题:
①羟基的电子式_____。
②与 H2 加成生成 2,5-二甲基己烷的炔烃的系统命名_____。
③写出 1,3-二溴丙烷与氢氧化钠水溶液共热的化学方程式_____。
④分子 式为 C6H14O 且含有“—CH2OH”的同分异构体的种数为(不考虑立体异构)_____。
(2)写出 1 个符合下列条件的物质的结构简式并用系统命名法命名:
a 与苯互为同系物; b 碳原子数小于10; c 一氯代物只有两种。______;_____。
(3)共轭二烯烃是含有两个碳碳双键,并且两个双键被一个单键隔开的二烯烃。最简单的共轭二烯烃是 1,3-丁二烯。 共轭二烯烃比较稳定。共轭二烯烃能以 1,4-和 1,2-两种形式发生加成反应,还可发生双烯合成反应(即 Diels-Alder 反应)等。用于合成橡胶、溶剂,是重要的有机化工原料。
①![]() 与一定量的Br2 发生加成反应,生成的产物可能是_______。
与一定量的Br2 发生加成反应,生成的产物可能是_______。
A 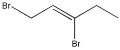 B
B ![]() C
C 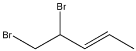 D
D ![]()
②双烯合成反应(即 Diels-Alder 反应)是一类二烯烃与单烯烃或炔烃作用生成六元环状化合物的反应,例如,最简单的 1,3-丁二烯和乙烯的作用表示为: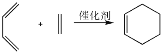 。则由 1-丁烯和 2-乙基-1,3-丁二烯发生双烯合成反应的产物为_____。
。则由 1-丁烯和 2-乙基-1,3-丁二烯发生双烯合成反应的产物为_____。
(4)环蕃 A(cyclophane)和超蕃 B(superphane)是一种光电信息材料,都属于烃(B 中氢原子未画出),它们的结 构如图所示。
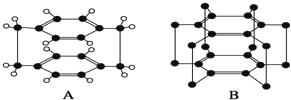
下列有关说法正确的是(________)
A 环蕃和超蕃互为同系物 B 环蕃能使酸性高锰酸钾溶液褪色
C 环蕃能与液溴、硝酸发生取代反应 D 超蕃的一氯取代物只有 l 种,二氯取代物有 3 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com