
【题目】原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
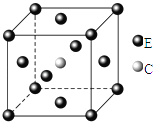
(1)B2A4分子中B原子轨道的杂化类型为________,B2A4分子中σ键和π键个数比为________
(2)A、B、C、D四种元素的电负性从大到小的顺序为________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是________
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是________
(4)元素E能形成多种配合物,如:E(CO)5等.
①基态E原子的价电子排布式为________.
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于________(填晶体类型),该晶体中E的化合价为________
【答案】sp2 5:1 O>N>C>H 氨气分子之间可形成氢键 N2O 3d64s2 分子晶体 0
【解析】
原子序数依次增大的五种元素A、B、C、D、E,其中A的一种核素中没有中子,则A为H元素;B原子基态时最外层电子数是其内层电子数的2倍,则该原子只能有2个电子层,最外层电子数为4,故B为C元素;D原子基态时2p原子轨道上有2个未成对的电子,且原子序数大于碳,故D核外电子排布为1s22s2p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍,则E的价电子排布为3d64s2,为Fe元素,据此分析解答。
由以上分析知,A为H元素,B为C元素,C为N元素,D为O元素,E为Fe元素,
(1)C2H4分子结构简式为H2C=CH2,C原子形成3个σ键,没有孤对电子,价层电子对数为3,故碳原子的轨道杂化类型为sp2杂化,1molC2H4含有σ键的数目为5mol,π键为1mol,则分子中σ键和π键个数比为5:1,故答案为:sp2;5:1;
(2)同周期元素随原子序数增大,元素电负性呈增大趋势,所以,C、H、O、N的电负性大小关系为O>N>C>H;因为氨气分子之间可形成氢键,所以化合物NH3的沸点比化合物CH4的高,故答案为:O>N>C>H;氨气分子之间可形成氢键;
(3)元素C、O形成的一种化合物与元素N、O形成的一种化合物互为等电子体,应是CO2与N2O,故答案为:N2O;
(4)①基态Fe原子的价电子排布式为3d64s2,故答案为:3d64s2;
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,所以Fe(CO)5晶体属于分子晶体,根据化合价代数和为0可知,该化合物中铁为0价,故答案为:分子晶体;0。


科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是目前使用最广泛的白色颜料。工业上,以钛铁矿(主要成分为钛酸亚铁[FeTiO3],含有少量SiO2杂质)为原料制备二氧化钛的过程如下图所示。
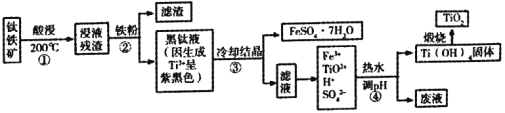
已知:①超过70℃TiO2+易水解;低于0℃ FeSO4·7H2O大量结晶。
②钛的化合价主要有+4价和+3价,其中Ti3+(紫黑色)还原性比Fe2+强
③有关氢氧化物开始沉淀的pH如下:
氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀时的pH | 0.5 | 3.0 | 1.5 | 7.6 |
根据相关信息回答下列问题;
(1)酸浸过程选用的酸是__________。
(2)步骤①中生成Fe2+和TiO2+的化学反应方程式为__________。
(3)以下相关描述正确的是__________。
A 步骤②中加入铁粉,在防止Fe2+转化成Fe3+的同时也将部分TiO2+氧化成了Ti3+
B 步骤③中的降温结晶过程可以选择冰水混合物
C ③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+
D 废液成分中有硫酸,可以循环利用
(4)步④中生成Ti(OH)4的离子方程式为__________,选择的pH范围是__________。
(5)证明步骤④中Ti (OH)4固体已经洗涤干净的方法是__________。
(6)钛酸锂(Li4Ti5O12)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示。下列有关叙述正确的是( )
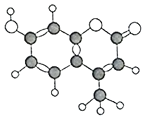
①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5mol H2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3mol Br2
⑦该物质遇FeCl3溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应
A.①②④⑥B.②④⑤⑥C.②④⑦⑧D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果汁发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是一种常见的有机酸,其结构简式为![]() 。
。
(1)苹果酸的分子式为___。
(2)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(3)苹果酸可能发生的反应是___(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下发生酯化反应
D.与乙醇在一定条件下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组说法均不正确的是( )
①CH3—CH=CH—C≡C—CF3 分子结构中最多有 4 个碳原子在一条直线上
②用催化加氢的方法可除去乙烷中混有的少量乙烯
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤14 g 乙烯和丙烯混合气体中的氢原子数为 2NA
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.②③⑥B.①③⑥C.②③④D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为合成聚合物F的路线图:
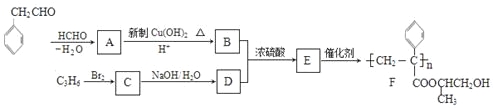
![]()
请根据以上信息,回答下列问题:
(1)A中含有官能团的名称是___________________,C的系统命名是___________。
(2)B+D→E的反应类型是_______。
(3)C生成D的反应化学方程式为__________,如果C与NaOH的醇溶液反应,则反应类型为__________。
(4)G物质的相对分子质量比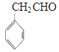 的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
①分子中含有苯环,且苯环上有两个取代基
②遇氯化铁溶液变紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的常见的纯净物,它们之间转化关系如图所示(可以在水溶液中反应)
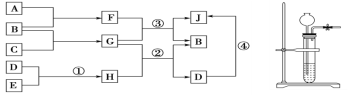
a.A、B、H在常温下均呈气态,F为液态,E为盐酸,D为溶于水的白色固体,A、B、C为单质,A在B中燃烧产生淡蓝色火焰。
b.实验室制取A、H的发生装置如图所示。
c.隔绝空气条件下,将G投入绿矾溶液中,有红褐色沉淀生成,还产生大量气泡。回答下列问题:
(1)化合物G中阳离子与阴离子个数之比为____________;J中所含化学键类型是____________________________________________。
(2)写出下列反应的化学方程式:
②_____________________________________________________;
③_____________________________________________________。
(3)反应①的离子方程式是____________________________________________
(4)化合物G有重要用途,用途为______________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com