
【题目】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是___(填字母)。
(2)下列操作合理的是___(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用240 mL容量瓶配制240mL 1 mol·L-1的氢氧化钠溶液
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为___mL。

(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.05 | 26.05 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.36 | 26.31 | 25.95 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度:c(NaOH)=___mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___(填字母)。
A.滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.锥形瓶用待测碱液润洗
D.滴定时酸式滴定管中盐酸洒落在锥形瓶外
【答案】ab A 26.10 0.1040 CD
【解析】
(1)量筒无“0”刻度;容量瓶只有刻度线,无“0”刻度;滴定管“0”刻度在最上面; 托盘天平游标上有“0”刻度,温度计有“0”刻度;
(2)A. NaHCO3溶液呈碱性;B.用托盘天平的精确度为0.1g;C. 100 mL量筒量程过大;D.实验室没有240 mL容量瓶;
(3)图2和图1数据相减即得溶液的体积;
(4)根据表格中数据可知第二次实验误差较大,数据舍去,根据c(NaOH)=![]() 进行计算;
进行计算;
(5)根据c(NaOH)=![]() 进行分析判断。
进行分析判断。
(1)由分析可知,只有量筒和容量瓶没有 “0”刻度,其余容器均有“0”刻度;
(2)A. NaHCO3溶液呈碱性,可用25 mL碱式滴定管量取20.00 mL,A项正确;
B.用托盘天平的精确度为0.1g,无法精确称量10.20 g碳酸钠固体,B项错误;
C. 100 mL量筒量程过大,应选择量程更小的量筒量取3.2 mL浓硫酸,C项错误;
D.实验室没有240 mL容量瓶,欲配制240mL 1 mol·L-1的氢氧化钠溶液应选择250mL容量瓶,D项错误;
答案选A;
(3)图2和图1数据相减即得溶液的体积=26.10mL-0.00mL=26.10mL;
(4)根据表格中数据可知第二次实验误差较大,数据舍去,盐酸的体积的平均值为![]() =26.00mL,c(NaOH)=
=26.00mL,c(NaOH)=![]() =
=![]() =0.1040mol/L;
=0.1040mol/L;
(5)A.滴定达终点时俯视滴定管内液面读数,读得的体积偏小,所测氢氧化钠溶液的浓度偏小,A项错误;
B.碱式滴定管用蒸馏水洗净后未用待测碱液润洗,实验消耗的碱溶液较多,所测氢氧化钠溶液的浓度偏小,B项错误;
C.锥形瓶用待测碱液润洗,增加了碱液的物质的量,所测氢氧化钠溶液的浓度偏大,C项正确;
D.滴定时酸式滴定管中盐酸洒落在锥形瓶外,读得盐酸体积偏大,所测氢氧化钠溶液的浓度偏大,D项正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】以玉米为原料进行综合利用,可以提高经济效益,减少对环境的污染。如图所示为用玉米作原料制取各物质的转化过程。
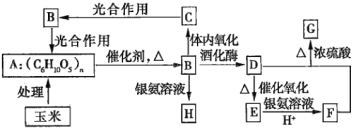
已知:
Ⅰ.G是具有果香气味的液体;D是重要的化工原料,并且可以代替汽油作汽车燃料。
Ⅱ.![]() 。
。
(1)A的名称为________,B的分子式为________,F的结构简式为________,G的结构简式为________。
(2)下列关于B的说法正确的是________(填序号)。
a.1molB能水解生成2molCH3CH2OH和2molCO2
b.欲检验A生成的B是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
c.B不能发生酯化反应
d.蔗糖的水解产物之一为B
(3)由C→B的能量转化过程中,能量的转化形式为________能转化为________能。
(4)D→E的化学方程式为________________。
(5)写出足量的F与甘油、浓硫酸在加热条件下发生反应的化学方程式:________________,反应类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
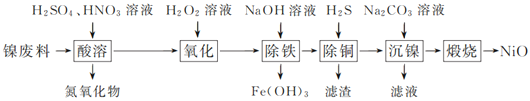
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
①称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为______ |
②将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为______ |
③另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) | (3)该有机物分子中含有羟基、羧基各1mol,羟基的电子式为______ |
④A的核磁共振氢谱如图:
| (4)A中含有______种氢原子 |
⑤综上所述,A的结构简式______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
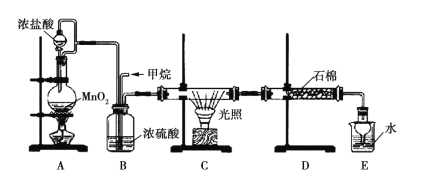
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。
①CH3CH2OH②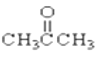 ③CH3CH2Br④
③CH3CH2Br④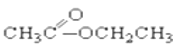 ⑤
⑤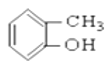 ⑥
⑥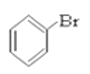 ⑦
⑦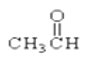 ⑧
⑧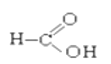 ⑨
⑨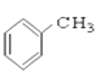 ⑩
⑩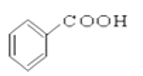
(1)芳香烃:_____________________________________________________
(2)卤代烃:_____________________________________________________
(3)醇:_________________________________________________________
(4)酚:_________________________________________________________
(5)醛:__________________________________________________________
(6)酮:__________________________________________________________
(7)羧酸:_________________________________________________________
(8)酯:__________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以证明乙醇分子中羟基上的氢原子所处环境与其他氢原子明显不同的是( )
A.1mol乙醇完全燃烧生成3mol![]()
B.乙醇可以制饮料
C.1mol乙醇跟足量的![]() 作用得0.5mol
作用得0.5mol![]()
D.1mol 乙醇在催化剂作用下可与氧气反应生成1mol乙醛.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com