
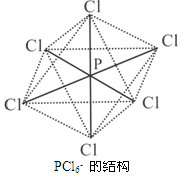
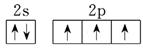
 (2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分);
(2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分); 。
。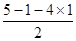 =0,即不存在孤对电子,由于磷原子的价层电子对数是4,所以空间构型是正四面体。
=0,即不存在孤对电子,由于磷原子的价层电子对数是4,所以空间构型是正四面体。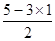 =1,即含有1对孤对电子,因此价层电子对数是4,所以N原子杂化方式是sp3杂化;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g)。氮气中含有三键,氯气中全部是单键,由于单键都是σ键,而三键是由1个σ键和2个π键构成的,因此在分解过程中形成σ键和π键数目之比为(3+1):2=2:1。
=1,即含有1对孤对电子,因此价层电子对数是4,所以N原子杂化方式是sp3杂化;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g)。氮气中含有三键,氯气中全部是单键,由于单键都是σ键,而三键是由1个σ键和2个π键构成的,因此在分解过程中形成σ键和π键数目之比为(3+1):2=2:1。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ||||
| 四 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①④⑤ | C.②④⑤ | D.②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
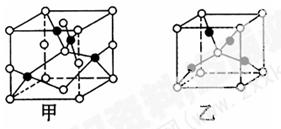
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沸点:H2O>H2S>H2Se>H2Te | B.稳定性:SiH4>PH3>H2S >HCl |
| C.熔点:SiC >KCl> I2>CO2 | D.沸点:CH4 >SiH4>GeH4>SnH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
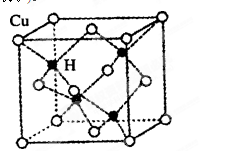
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com