
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线_______(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_________。
CH3OH(g)的△H=_________。
(2)从反应开始到建立平衡,v(CO)=________;达到平衡时,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________。
【答案】 b -91kJ/mol 0.075mol/(L·min) 12 正向 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-281kJ/mol
【解析】考查化学反应与能量的关系,热化学方程式的书写,盖斯定律的应用,化学平衡理论,反应速率的计算(1)根据催化剂的作用知使用催化剂,降低了反应的活化能,反应速率快;(2)根据化学平衡常数计算公式进行计算;(3)根据盖斯定律完成热化学方程式的书写。
(1)由图像分析b的活化能比a的低,说明使用了催化剂,降低了反应的活化能,反应速率快,所以曲线b表示使用了催化剂;反应热只与始态和终态有关,与反应途经无关。所以反应的反应热不变,△H =419 KJ/mol-510 KJ/mol=-91 KJ/mol;答案:b ;-91kJ/mol。
(2)根据图2分析知道:达平衡时,CO的浓度减小1.00-0.25=0.75mol/L,所以v(CO)= 0.75mol.L-1/10min=0.075mol·L-1·min-1;起始时氢气的浓度为2mol/L,是CO起始浓度的2倍,符合化学方程式中的化学计量数之比,所以平衡时CO的浓度是0.25 mol/L,氢气的浓度为0.5mol/L,甲醇的浓度是0.75 mol/L,化学平衡常数K=0.75 mol.L-1/0.25 mol.L-1×0.52mol/L=12;达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,压强增大了,CO(g)+2H2(g)![]() CH3OH(g)的平衡正向移动。答案:0.075mol/(L·min) 12 正向 。
CH3OH(g)的平衡正向移动。答案:0.075mol/(L·min) 12 正向 。
(3)①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH=-193kJ/mol,②H2O(l)= H2O(g) ΔH=+44 kJ/mol,根据盖斯定律,所求热化学方程式=①-②×2,32g的CH3OH(g)的物质的量是1mol,所以热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol。


科目:高中化学 来源: 题型:
【题目】近年来连续出现的铊中毒事件,给各科研单位及学校危险药品的管理敲响了警钟。铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期第________族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为____________。
(3)下列推断正确的是________。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有xMm﹣和yNn+两种简单离子,它们的电子层结构相同.则表示M元素质子数的正确表达式是( )
A.x=y﹣n﹣m
B.x=y+n+m
C.x=y+n﹣m
D.x=y﹣n+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
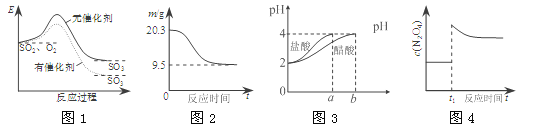
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D.图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是__________
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得Ca(ClO)2产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1molCl2,转移电子的物质的量为__________mol。
(5)有效氯是漂粉精中有效Ca(ClO)2的含量大小的标志。已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)![]() 100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物分子的比例模型示意图。下列说法正确的是( )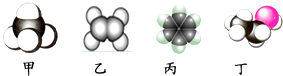
A.甲是甲烷,甲烷的二氯取代产物只有一种结构
B.乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色
C.丙是苯,苯结构比较稳定,不能发生氧化反应
D.丁是乙酸,一定条件下乙酸能跟乙醇发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式。
(1)利用铝热反应焊接钢轨的化学方程式为_________________________。
(2)实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为__________________。
(3)乙醇与金属钠反应的化学方程式为___________________________。
(4)苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为__________________。
(5)氯化铝溶液与氨水制备氢氧化铝的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com