
【题目】(10分)碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是______(写出元素符号)。
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为________;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是___________________。

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是____________。
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有________个C60分子。
【答案】(1)O (2)sp2 甲醇分子间存在氢键,而丙烯分子间只有范德华力 (3)6 (4)4
【解析】
试题(1)C原子核外未成对电子数是2,与碳同周期,说明处于第二周期,且基态原子的核外未成对电子数是2的元素是O元素。
(2)石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论知C原子杂化类型为sp2;相同温度下,含有分子间氢键的物质熔沸点较高,甲醇分子间形成氢键、丙烯分子间只存在范德华力,所以常温下甲醇是液态、丙烯是气态。
(3)金刚石中最小环上含有6个C原子,Si和金刚石结构相似,所以每个最小环上含有6个Si原子,二氧化硅晶体相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,所以Si、O形成的最小环上O原子数目是6。
(4)每个晶胞中C60分子个数=8×![]() +6×
+6×![]() =4。
=4。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
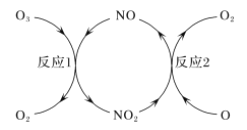
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
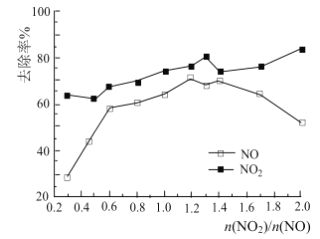
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
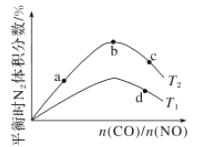
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A. 某元素原子的第二电子层电子排布图为![]()
B. 某元素在某种化合物中的化合价为+4
C. 某元素的原子最外层上电子数为6
D. 某元素的外围电子排布式为5s25p1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
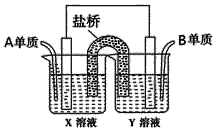
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
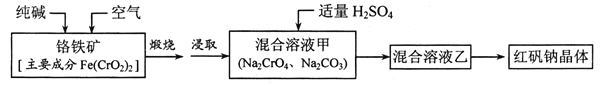
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
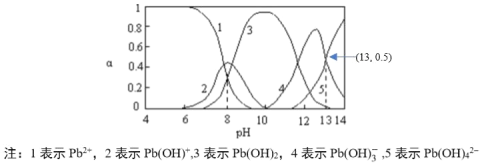
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为研究各种条件对氧化还原反应的影响进行了下列实验:
(1)研究![]() 和
和![]() 之间的氧化还原反应:(已知Cr2O72-橙色、CrO42-黄色和Cr3+绿色)
之间的氧化还原反应:(已知Cr2O72-橙色、CrO42-黄色和Cr3+绿色)
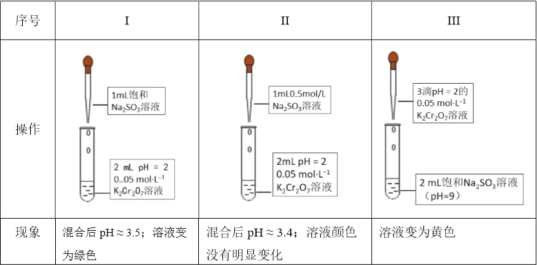
①用离子方程式解释Na2SO3溶液显碱性的原因____。
②I和II对比得出的结论是____。
③结合平衡移动原理解释III中的实验现象____。
④为了研究III和I的实验现象差别,该同学在III中滴加少量硫酸(无气泡冒出),发现溶液变为绿色。“变为绿色”的可能原因是____。
(2)利用如图装置(同样的装置有若干)研究Fe3+和I-之间的氧化还原反应:
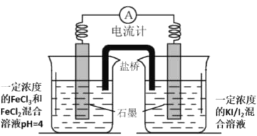
a.初始状态指针不偏转
b.若向a的左侧溶液中滴加少量饱和FeCl3溶液(混合后pH≈2.3),指针明显左偏
c.若向a的右侧溶液中滴加饱和KI溶液,指针明显左偏
①为了证明b中是由于Fe3+浓度增大导致其氧化性增强而发生氧化还原反应需要补充的实验操作及现象为:_____。
②该同学用电热棒对左侧烧杯溶液进行加热后观察到电流计指针明显左偏。可能原因是____。
(3)由上述实验可知,影响氧化还原反应的条件有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物在自然界中的部分循环关系如图。
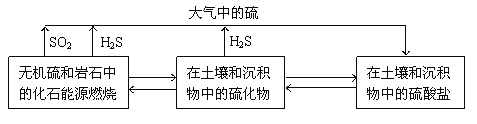
(1)H2S在空气中可以燃烧。
已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.38kJ/mol
S(s)+O2(g)=SO2(g) ΔH=-297.04kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是____。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会____(填“升高”、“不变”或“降低”)。
②为调整海水的pH,可加入新鲜的海水,使其中的HCO3-参与反应,其反应的离子方程式是____。
③在上述反应的同时需要大量鼓入空气,其原因是____。
(3)某科研单位利用工业废气中的SO2来制取H2SO4。
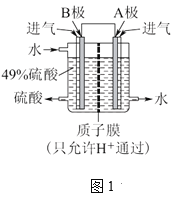
①利用原电池原理,用SO2和O2来制备硫酸,装置如图1所示。B极的电极反应式是____。
②SO2经图2中的两个循环可分别得到S和H2SO4。下列说法正确的是____。
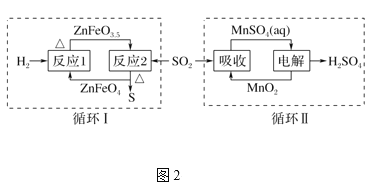
a.循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
b.循环Ⅰ中,反应2的化学方程式为SO2+4ZnFeO3.5![]() S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
d.循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com