
【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
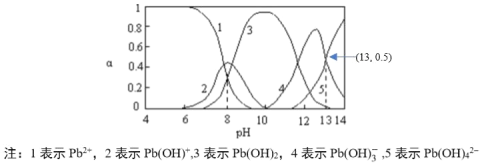
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
【答案】PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H=![]() kJ·mol-1 < 9.09%或
kJ·mol-1 < 9.09%或![]() bc Pb(OH)3-+OH-=Pb(OH)42- 10
bc Pb(OH)3-+OH-=Pb(OH)42- 10
【解析】
⑴利用盖斯定律将第1个方程2倍加上第3个方程式2倍,减去第2个方程式的3倍,再同时除以3。
⑵①升高温度,平衡常数减小,平衡逆向移动,逆向是吸热反应,正向是放热反应;②根据平衡常数![]() ,计算混合气体中CO的体积分数。
,计算混合气体中CO的体积分数。
⑶a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+。
⑷向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时,根据图中信息,主要是Pb(OH)3-与OH-反应生成Pb(OH)42,根据平衡常数公式进行计算。
⑴利用盖斯定律将第1个方程2倍加上第3个方程式2倍,减去第2个方程式的3倍,再同时除以3,则得到方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =![]() kJ·mol1;故答案为:PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =
kJ·mol1;故答案为:PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =![]() kJ·mol1。
kJ·mol1。
⑵①升高温度,平衡常数减小,平衡逆向移动,逆向是吸热反应,正向是放热反应,因此d<0;故答案为:<。
②![]() ,则混合气体中CO的体积分数
,则混合气体中CO的体积分数![]() ;故答案为:9.09%或
;故答案为:9.09%或![]() 。
。
⑶新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O;a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少,故a错误;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动,故b正确;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+,故c正确;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+,故d错误;综上所述,答案为:bc。
2Pb2++2H2O;a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少,故a错误;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动,故b正确;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+,故c正确;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+,故d错误;综上所述,答案为:bc。
⑷向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时,根据图中信息,主要是Pb(OH)3-与OH-反应生成Pb(OH)42,其主要的离子反应方程式是Pb(OH)3-+OH-=Pb(OH)42,其平衡常数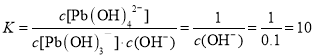 ;故答案为:Pb(OH)3-+OH-=Pb(OH)42;10。
;故答案为:Pb(OH)3-+OH-=Pb(OH)42;10。


科目:高中化学 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
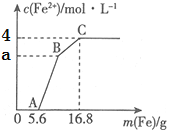
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜又称亚硫酰氯,其分子式为 SOCl2,常温常压下为淡黄色液体,遇水易水解。国内的氯化亚砜主要应用于医药、农药、染料等行业。实验室用干燥纯净的 Cl2、SO2 和 SCl2 制备 SOCl2 的部分装置如图所示:

已知:①SOCl2 沸点为 78.8℃,SCl2 的沸点为 50℃,且两种液体可互溶。
②SOCl2 遇水剧烈反应,液面上产生白雾,并有气体产生。
请回答:
(1)实验室制取 SOCl2 的反应方程式为____________
(2)写出丙中发生的离子反应_____________
(3)仪器 e 的名称是___________,实验仪器的连接顺序为a→_________(仪器可以重复使用)。
(4)仪器 f 的作用是 ____________
(5)实验结束后,将三颈烧瓶中混合物分离的实验操作名称是______。
(6)工业上常用 ZnCl2·2H2O 与 SOCl2 共热制取 ZnCl2。写出用惰性电极电解ZnCl2和盐酸的混合溶液的总反应离子反应式为_______。甲同学认为 SOCl2还可用作FeCl3·6H2O 制取无水 FeCl3的脱水剂,但乙同学对此提出质疑,可能的原因是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是______(写出元素符号)。
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为________;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是___________________。

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是____________。
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有________个C60分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁与盐酸反应:Fe+2H+=Fe3++H2↑
B.氧化镁与稀硫酸反应:O2-+2H+=H2O
C.硫酸铜与氢氧化钡溶液反应:Ba2++SO![]() = BaSO4↓
= BaSO4↓
D.氯气通入氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要使用1.0mol/LNaOH溶液80mL。
(1)配制该NaOH溶液所需容量瓶的规格是________。
(2)用托盘天平称取NaOH固体________g。
(3)称量完成后,进行如下操作:
A.将称好的NaOH固体放在烧杯中,用适量蒸馏水溶解。
B.待固体全部溶解后,将溶液立即转移到容量瓶。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也都用玻璃棒引流注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀。
D.继续向容量瓶加蒸馏水至液面离容量瓶颈刻度线下________cm时,改用_________滴加蒸馏水至溶液的凹液面与刻度线相切。
E.盖好瓶塞,反复上下颠倒,摇匀。
上述操作不正确的是________(填序号)。
(4)若未进行上述操作C,则所得溶液浓度________(填“偏高”“偏低”或“无影响”,下同)。若定容时如下图操作,则所得溶液浓度________。
(5)取上述溶液10mL稀释至50mL,所得NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镁享有“国防金属”的美誉,目前世界上百分之六十的镁是从海水中提取的,主要反应为:MgCl2+Ca(OH) 2=Mg(OH) 2↓+CaCl2。若往200mL浓缩海水中加入0.37g Ca(OH)2使Mg2+沉淀完全,请计算:
(1)生成沉淀的物质的量________。
(2)该浓缩海水中Mg2+的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.炭粉上发生的反应为:O2+4e-+4H+=2H2O
D.吸收氧气的过程中,铁作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。下列由此得出的说法中,错误的是
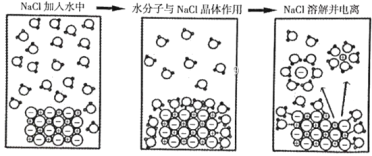
A.在H2O分子中,H或O原子均完全不带电荷
B.在NaCl晶体中,Na+和Cl-的排列整齐有序
C.Na+、Cl![]() 在水中是以水合离子的形式存在
在水中是以水合离子的形式存在
D.NaCl晶体的溶解和电离过程破坏了离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com