
����Ŀ��ijͬѧΪ�о�����������������ԭ��Ӧ��Ӱ�����������ʵ�飺
��1���о�![]() ��
��![]() ֮���������ԭ��Ӧ������֪Cr2O72-��ɫ��CrO42-��ɫ��Cr3+��ɫ��
֮���������ԭ��Ӧ������֪Cr2O72-��ɫ��CrO42-��ɫ��Cr3+��ɫ��
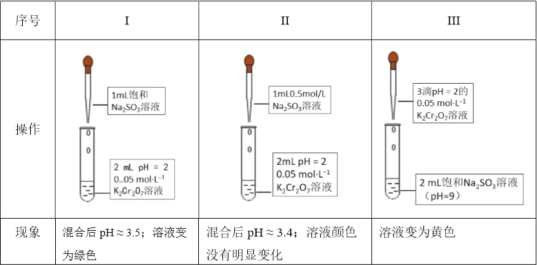
�������ӷ���ʽ����Na2SO3��Һ�Լ��Ե�ԭ��____��
��I��II�Աȵó��Ľ�����____��
�۽��ƽ���ƶ�ԭ������III�е�ʵ������____��
��Ϊ���о�III��I��ʵ�������𣬸�ͬѧ��III�еμ��������ᣨ������ð������������Һ��Ϊ��ɫ������Ϊ��ɫ���Ŀ���ԭ����____��
��2��������ͼװ�ã�ͬ����װ�������ɣ��о�Fe3+��I-֮���������ԭ��Ӧ��
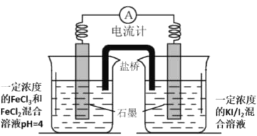
a.��ʼ״ָ̬�벻ƫת
b.����a�������Һ�еμ���������FeCl3��Һ����Ϻ�pH��2.3����ָ��������ƫ
c.����a���Ҳ���Һ�еμӱ���KI��Һ��ָ��������ƫ
��Ϊ��֤��b��������Fe3+Ũ������������������ǿ������������ԭ��Ӧ��Ҫ�����ʵ�����������Ϊ��_____��
�ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ������ԭ����____��
��3��������ʵ���֪��Ӱ��������ԭ��Ӧ��������_____��
���𰸡�SO32-+H2O![]() HSO3-+OH- �����������䣬SO32-Ũ��Խ���仹ԭ��Խǿ Cr2O72-����ɫ��+H2O2
HSO3-+OH- �����������䣬SO32-Ũ��Խ���仹ԭ��Խǿ Cr2O72-����ɫ��+H2O2![]() 2CrO42-����ɫ��+2H+����Һ�д�����SO32-(��OH-)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��� �����������䣬��Һ����ԽǿCr��VI����������ǿ����S��IV����ԭ����ǿ�������ͬʱ��ǿ���������𰸣��������������䣬Cr2O72-�������Ա�CrO42-ǿ�����������²��ܷ�Ӧ�� ��aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת���� �¶����������Fe3+���������� ��Ӧ���Ũ�ȡ��¶ȡ���Һ�������
2CrO42-����ɫ��+2H+����Һ�д�����SO32-(��OH-)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��� �����������䣬��Һ����ԽǿCr��VI����������ǿ����S��IV����ԭ����ǿ�������ͬʱ��ǿ���������𰸣��������������䣬Cr2O72-�������Ա�CrO42-ǿ�����������²��ܷ�Ӧ�� ��aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת���� �¶����������Fe3+���������� ��Ӧ���Ũ�ȡ��¶ȡ���Һ�������
��������
�Ţ�Na2SO3��Һ�Լ�����Ҫ���������ˮ�⣻��I��II�Ա�I��SO32Ũ�ȴ�Ӧ��������ɫ��Cr3+����II��SO32Ũ��С����Һû�����Ա仯���۸���ͼ����Ϣ��ʵ������ó�Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ����ܸ�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+���������
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ����ܸ�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+���������
�Ƣٸ���ͼ����Ϣԭ����Һ��pH =4��ΪpH =2.3��������ǿ��Ϊ��֤��b��������Fe3+Ũ������������������ǿ��Ӧ�ò����Ƿ���������ǿ����ǿFe3+�������ԣ��ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ��˵���¶����߿��������Fe3+���������ԡ�
��������ʵ���֪����Ӧ��Ũ������������ǿ���¶�����Ӧ���ʶ���ӿ졣
�Ţ�Na2SO3��Һ�Լ�����Ҫ���������ˮ�⣬��ԭ����SO32+H2O![]() HSO3��+OH�����ʴ�Ϊ��SO32+H2O
HSO3��+OH�����ʴ�Ϊ��SO32+H2O![]() HSO3�� + OH����
HSO3�� + OH����
��I��II�Ա�I��SO32Ũ�ȴ�Ӧ��������ɫ��Cr3+����II��SO32Ũ��С����Һû�����Ա仯����˵ó��Ľ����������������䣬SO32Ũ��Խ���仹ԭ��Խǿ��
�۸���ͼ����Ϣ��ʵ������ó�Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ƣ��ʴ�Ϊ��Cr2O72(��ɫ)+H2O2
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ƣ��ʴ�Ϊ��Cr2O72(��ɫ)+H2O2![]() 2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ơ�
2CrO42(��ɫ)+2H+����Һ�д�����SO32(��OH��)��H+��ϵ�����Һ��c(H+)�½���ƽ�������ƶ�����Һ��ɫ��ơ�
��Ϊ���о�III��I��ʵ�������𣬸�ͬѧ��III�еμ���������(������ð��)��������Һ��Ϊ��ɫ��������ǿ�������Cr2O72����������ǿ�����������������ԭ����ǿ�����߷���������ԭ��Ӧ����Cr3+����������ʴ�Ϊ�������������䣬��Һ����ԽǿCr(VI)��������ǿ����S(IV)��ԭ����ǿ�������ͬʱ��ǿ(�������𰸣��������������䣬Cr2O72�������Ա�CrO42ǿ�����������²��ܷ�Ӧ)��
�Ƣٸ���ͼ����Ϣԭ����Һ��pH =4��ΪpH =2.3��������ǿ��Ϊ��֤��b��������Fe3+Ũ������������������ǿ��Ӧ�ò����Ƿ���������ǿ����ǿFe3+�������ԣ���˲����ʵ�����������Ϊ����aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת�������ʴ�Ϊ����aװ����ܵμ�����ŨHClʹ��ҺpH��2.3��ָ�벻ƫת��ƫת������
�ڸ�ͬѧ�õ��Ȱ�������ձ���Һ���м��Ⱥ�۲쵽������ָ��������ƫ��˵�������ӱ�Ϊ�������ӣ���˿���ԭ�����¶����������Fe3+���������ԣ��ʴ�Ϊ���¶����������Fe3+���������ԡ�
��������ʵ���֪����Ӧ��Ũ������Ӧ���ʼӿ죬������ǿʹ�÷�Ӧ���ʼӿ죬�¶�����Ӧ���ʼӿ죬�Ӷ��ó�Ӱ��������ԭ��Ӧ�������з�Ӧ���Ũ�ȡ��¶ȡ���Һ������ԣ��ʴ�Ϊ����Ӧ���Ũ�ȡ��¶ȡ���Һ������ԡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol�л�������A���״����5.6L������ϣ�һ��������������ȫ��Ӧ��ֻ��CO��CO2��H2O���ֲ����ȫ����������ͨ��������Ũ����ͼ�ʯ���У�Ũ��������5.4g����ʯ������4.4g�����б�״����2.24L�����ʣ�࣬��
(1)�л�������A�ķ���ʽ___________��
(2)���л�������A�����Ʒ�Ӧ�ų���������д��A�Ľṹ��ʽ___________��
(3)д�����б�A��һ����CH2��ԭ���ŵ�ͬϵ��Ľṹ��ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣�̼Ԫ�������������о��зdz���Ҫ�����ã��������ʵ��Ʊ���Ҳ�����˾������ص����á�
��1����̼ͬ���ڣ��һ�̬ԭ�ӵĺ���δ�ɶԵ�������ȵ�Ԫ����______(д��Ԫ�ط���)��
��2��ʯīϩ��Ŀǰ��������������ʣ����������ɵ���̼ԭ��������ƽ�̶��ɵģ���һ��ֽһ��(��ͼ��)��ʯīϩ��̼ԭ�ӵ��ӻ���ʽΪ________�����������±�ϩ����̬������Է��������ȱ�ϩС�ļ״�������������ȴ��Һ̬���������������ԭ����___________________��

��3����������ṹ�����ʯ�ṹ���ƣ�����������Ľṹ�൱���ڹ辧��ṹ��ÿ�������Ļ�ѧ��֮�����һ��Oԭ�ӡ��۲�ͼ���н��ʯ�Ľṹ��������������Ŀռ���״�ṹ�У�Si��O�γɵ���С����Oԭ����Ŀ��____________��
��4��ͼ����C60�ľ���ģ��(һ��С�ڵ����һ��C60����)��ͼ����ʾ����C60������Ϊ14����ʵ����һ��C60�����к���________��C60���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫʹ��1.0mol/LNaOH��Һ80mL��
(1)���Ƹ�NaOH��Һ��������ƿ�Ĺ����________��
(2)��������ƽ��ȡNaOH����________g��
(3)������ɺ������²�����
A.���ƺõ�NaOH��������ձ��У�����������ˮ�ܽ⡣
B.������ȫ���ܽ����Һ����ת�Ƶ�����ƿ��
C.����������ˮϴ���ձ��Ͳ�����2��3�Σ�ϴ��ҺҲ���ò���������ע������ƿ������ҡ������ƿ��ʹ��Һ��Ͼ��ȡ�
D.����������ƿ������ˮ��Һ��������ƿ���̶�����________cmʱ������_________�μ�����ˮ����Һ�İ�Һ����̶������С�
E.�Ǻ�ƿ�����������µߵ���ҡ�ȡ�
������������ȷ����________(�����)��
(4)��δ������������C����������ҺŨ��________(�ƫ�ߡ���ƫ�͡�����Ӱ�족����ͬ)��������ʱ����ͼ��������������ҺŨ��________��
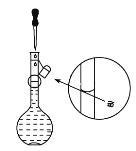
(5)ȡ������Һ10mLϡ����50mL������NaOH��Һ�����ʵ���Ũ��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ������������������������Ŀǰ�����ϰٷ�֮��ʮ��þ�ǴӺ�ˮ����ȡ�ģ���Ҫ��ӦΪ��MgCl2+Ca(OH) 2=Mg(OH) 2��+CaCl2������200mLŨ����ˮ�м���0.37g Ca(OH)2ʹMg2+������ȫ������㣺
(1)���ɳ��������ʵ���________��
(2)��Ũ����ˮ��Mg2+�����ʵ���Ũ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��ҺX����Na+��Ag+��Ba2+��Al3+��Fe3+��AlO2����CO32����SO42���е�������������ɣ�ȡ����Һ��������ʵ�飺
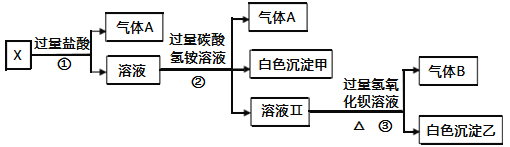
(1)����A�ijɷ���________(�ѧʽ����ͬ)������B�ijɷ���________��
(2)д������ٷ�����Ӧ���������ӷ���ʽ________________________��
(3)д��������γɰ�ɫ���������ӷ���ʽ________________________��
(4)ͨ������ʵ�飬��ȷ��X��Һ��һ�����ڵ�������________����δȷ���Ƿ���ڵ�������________��ֻҪ���һ���ĺ���ʵ��Ϳ���ȷ���������Ƿ���ڣ��÷�����________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ�������õ���˫�����������ɻ�ԭ���ۡ���ʯ�ҡ��Ȼ��ơ�̿�۵Ȱ�һ��������ɵĻ���������������ˮ�����з�������ȷ���ǣ� ��
A.��˫�������е���ʯ������ˮ����
B.��˫��������������ʱ��������ԭ��ط�Ӧ
C.̿���Ϸ����ķ�ӦΪ��O2+4e-+4H+=2H2O
D.���������Ĺ����У�����ԭ��صĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A | B | C | D | |
ʵ�鷽�� |
���ڹ����� |
Ƭ�̺���Fe�缫��������K3[Fe(CN)6]��Һ |
|
|
ʵ��Ŀ�� | ��֤����������������ѧ��Ӧ | ��֤Fe�缫������ | ��֤��Ȳ�Ļ�ԭ�� | ��֤�����������ⸯʴ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��������ͼװ�����Ʊ���ˮAlCl3����֪����ˮAlCl3��ˮ��Ѹ�ٷ�����Ӧ��������˵����ȷ����
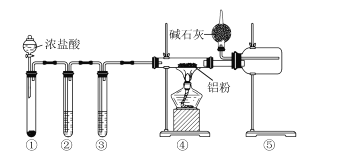
A.װ�â��е��Լ������Ƕ�������
B.װ�âڡ����е��Լ��ֱ�ΪŨ���ᡢ����ʳ��ˮ
C.��ȼ�ܴ��ƾ���֮ǰ���ž�װ���еĿ���
D.���θ�����м�ʯ�ҵ�����ֻ�д���β��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com