
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 在大气中有两种同素异形体且均能支持燃烧,X 单质能在 Z2 气体中燃烧,发出黄色火焰,Y 在同周期非金属元素中原子半径最大。下列叙述正确的是
A.Y 单质的熔点低于 X 单质
B.Z 的含氧酸均为弱酸
C.Y、Z 的单质都能在 W2 气体中燃烧
D.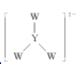 中 W 和 Y 都满足 8 电子稳定结构
中 W 和 Y 都满足 8 电子稳定结构
科目:高中化学 来源: 题型:
【题目】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根、酸根离子)的组成分数如图所示。下列说法正确的是

A. HX-的电离程度小于水解程度
B. 在pH=7的溶液中HX-和X2-能大量共存
C. 在pH=9时,H2X 与NaOH恰好完全中和
D. 1L.0.1 molL-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验,能达到实验目的的是( )
A.  证明稳定性:Na2CO3>NaHCO3
证明稳定性:Na2CO3>NaHCO3
B.  证明非金属性:Cl>Br>I
证明非金属性:Cl>Br>I
C.  验证镁和盐酸反应的热效应
验证镁和盐酸反应的热效应
D. 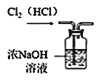 除去 Cl2 中的杂质气体 HCl
除去 Cl2 中的杂质气体 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
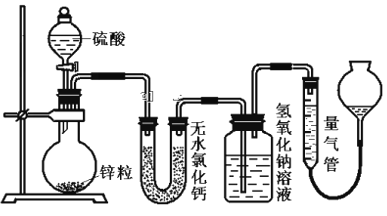
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_______________________
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到V mL气体,则有: ![]() =
=![]() +
+![]() ,依据的原理是____________________________。
,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,![]() =_______________(用含字母的代数式表示)。
=_______________(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
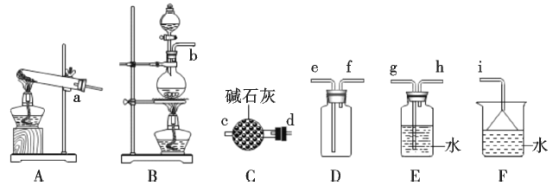
(1)氨气的制备
①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
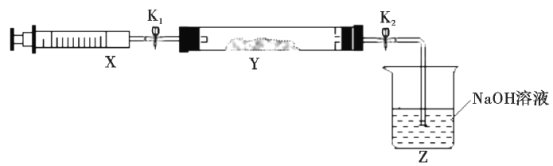
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__ | ②反应的化学方程式___ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③__ | ④___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中“实验内容”与对应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往4 mL 0.1 mol/L 、4 mL 0.2 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 25℃时,向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
C | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
D | 向FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度,平衡逆向移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 难溶电解质的溶度积越小,溶解度越大 B. 难溶电解质的溶解平衡是一种动态平衡
C. 可以通过沉淀反应使杂质离子完全沉淀 D. 一定浓度的NH4Cl溶液不能溶解Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com