
【题目】某温度下,向容积可变的密闭容器中充入醋酸的二聚物![]() ,发生反应:
,发生反应:![]() 。测得平衡时混合气体的平均摩尔质量
。测得平衡时混合气体的平均摩尔质量![]() 与温度
与温度![]() 、压强
、压强![]() 的关系如图所示。下列有关说法错误的是( )
的关系如图所示。下列有关说法错误的是( )
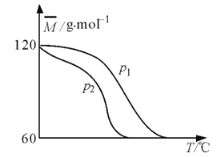
A.![]()
B.当![]() 时,平衡常数
时,平衡常数![]()
C.保持温度不变,增大压强,平衡左移,![]() 增大
增大
D.![]() 条件下,保持温度不变,向容器中加入少量
条件下,保持温度不变,向容器中加入少量![]() ,
,![]() 平衡转化率增大
平衡转化率增大
科目:高中化学 来源: 题型:
【题目】含有酚类物质的废水来源广泛,危害较大。含酚废水不经处理排入水体,会危害水生生物的繁殖和生存;饮用水含酚,会影响人体健康。某科研结构研究出一种高效光催化剂BMO(Bi2MoO6),可用于光催化降解丁基酚,原理如图所示。下列说法错误的是( )
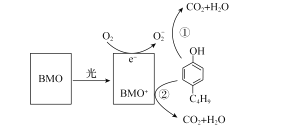
A.光催化剂BMO可降低丁基酚氧化反应的ΔH
B.在丁基酚氧化过程中BMO表现出强还原性
C.苯环上连有一OH和一C4H9的同分异构体共有12种(不考虑立体异构)
D.反应中BMO参与反应过程且可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期主族元素,
是原子序数依次增大的短周期主族元素,![]() 在氧气中燃烧生成淡黄色固体。
在氧气中燃烧生成淡黄色固体。![]() 与其它四种元素不同周期,
与其它四种元素不同周期,![]() 相邻。
相邻。![]() 的最外层电子数是
的最外层电子数是![]() 次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
次外层电子数的一半,两者形成的化合物结构如图所示。下列说法错误的是( )
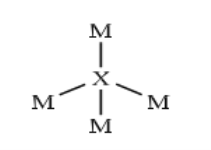
A.气态氢化物稳定性:![]()
B.简单离子半径:![]()
C.![]() 的氧化物可能均具有漂白性
的氧化物可能均具有漂白性
D.Y分别与![]() 形成的二元化合物均含离子键
形成的二元化合物均含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
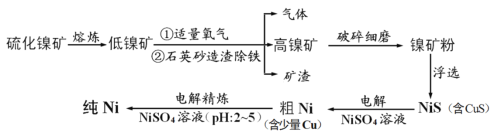
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):

下列说法错误的是
A.Na2S2O4中S元素的化合价为+3
B.装置Ⅱ消耗36 g 水生成4 NA个H+(NA代表阿伏伽德罗常数)
C.装置Ⅲ用甲烷燃料电池进行电解,当消耗24 g 甲烷时,理论上可再生10 mol Ce4+
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们致力于消除氮氧化物对大气的污染。回答下列问题:
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)
2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)![]() N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
(2)温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
①容器Ⅱ在反应的起始阶段向_____(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为___________
a. >1 b. =1 c. <1

(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
(4)可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
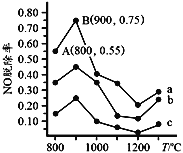
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是_____。
(5)还可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质的是__________________。
②写出电解池阴极的电极反应式_______________。
③用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
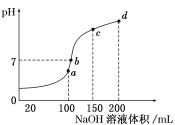
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com