
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
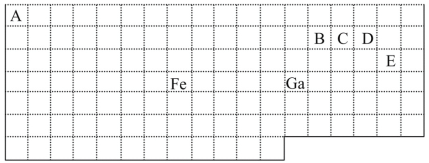
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
【答案】1s22s22p63s23p63d104s24p1 d 0 N2 CN- CH3OH 正四面体形 CO2、NCl3、CCl4、CO(任写2个)
【解析】
(1)主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,所以根据能量最低原理先排4s电子后排3d电子;Fe与CO易形成配合物Fe(CO)5,根据化合物的化合价代数和为0,所以Fe(CO)5的化合价代数和为0,CO是化合物,它的化合价的代数和是0,所以在Fe(CO)5中铁的化合价为 0;
(3)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,CO分子含两个原子,且组成该物质的元素一个是6号一个是8号,找它的等电子体时,如果是分子,就把两种元素的原子序数一个增大1一个减小1,如果是离子,其中一种元素不变,另一种原子序数增大(或减小),带正电荷(或负电荷);判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,如:如果是直线型,采取的就是sp杂化;
(4)根据杂化轨道理论判断分子空间构型。
(1)31号元素Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(2)26号元素Fe元素在周期表的位于第四周期第Ⅷ族,位于周期表的d区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0价,故答案为:d;0;
(3)与CO分子互为等电子体的分子是N2,离子为CN-;在CO、CH3OH中,碳原子采取sp3杂化的分子有CH3OH;CO中的C原子的杂化方式为sp杂化,故答案为:N2;CN-;CH3OH;
(4)根据表格中各种元素的相对位置可以看出:A是H;B是C;C是N;D是O;E是Cl,则ED4-离子ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=1/2(a-xb),说明:x为配位原子个数,b为配位原子最多能接受的电子数,对于阴离子,a为中心原子的价电子数+离子所带的电荷数,中心原子上的孤电子对数=1/2(a-xb)=1/2(8-5×2)=0,所以价层电子对数=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;在C、N、O、Cl原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有CO2、NCl3、CCl4、CO(任写2个),故答案为:正四面体形;CO2、NCl3、CCl4、CO(任写2个)。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Iˉ、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀;
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A.(2)中产生的气体可能含有SO2
B.溶液X中一定存在![]() 、
、![]() 、Mg2+
、Mg2+
C.溶液X中一定不存在Fe3+,可能存在Iˉ
D.无法确定溶液中是否含有Na+,需要做焰色反应才能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构。
②Z元素原子核内质子数比Y元素原子核内质子数少9个。
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的元素符号:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式为___________。
(3)Y-的电子式____________。
(4)用电子式表示X、Z形成化合物的过程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价
是_________,该反应中氧化剂和还原剂的物质的量之比为_____________。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色MnO2沉淀生成。
①ClO2和MnO2均属于氧化物,理由是___________________。
②该反应的离子方程式为_____________________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mg L-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,其关系如下图所示:

①实验中使用的C1O2溶液的物质的量浓度为____________(保留三位有效数字);要使NO的去除率更高,应控制的条件是__________________________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaC1O2,写出碱性条件下NaClO2脱除NO反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___,B:____,C:____,D:____。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___,D:___。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____。
(4)写出B2A4的电子式:____。
(5)写出C3B2化合物与水反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
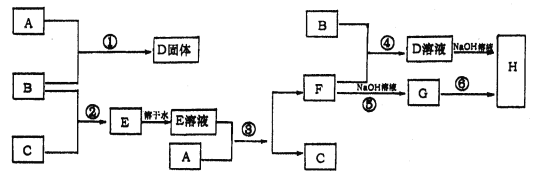
(1)A是_____________,B是______________,C是___________(填化学式)
(2)反应⑥的化学方程式为:__________________________________________。
(3)反应④的离子方程式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___,B:____,C:____,D:____。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___,D:___。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____。
(4)写出B2A4的电子式:____。
(5)写出C3B2化合物与水反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
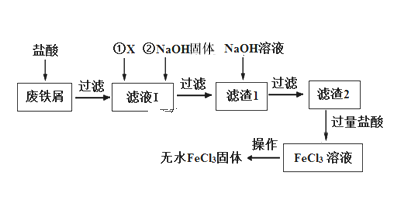
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:
已知:氢氧化物的Ksp如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X可以选用下列物质中的____(选填序号)
A.NaCl B.FeCl3 C.H2O2 D.H2SO4
(2)滤液Ⅰ加入NaOH固体的目的是调节溶液的pH(忽略加入NaOH固体以后溶液体积的变化)。已知滤液Ⅰ中c(Fe3+)为1.0 mol·L-1,c(Al3+)为0.03 mol·L-1,c(Mg2+)为0.01 mol·L-1,当Fe3+恰好沉淀完全时[c(Fe3+)=1×10-5 mol·L-1],Al3+是否已经开始沉淀______(填“是”或“否”)。
(3)写出滤渣1加NaOH溶液发生反应的离子方程式_____________________。
(4)生产流程中最后“从FeCl3溶液得到无水FeCl3固体”的操作分为两步:第一步,先冷却结晶得到FeCl3·6H2O晶体;第二步,制无水FeCl3固体。第二步的正确操作是_____。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是____________________(用离子方程式表示)
②通过控制条件生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
a.降温 b.加氨水 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com