
【题目】设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构。
②Z元素原子核内质子数比Y元素原子核内质子数少9个。
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的元素符号:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式为___________。
(3)Y-的电子式____________。
(4)用电子式表示X、Z形成化合物的过程____________。
【答案】钾 氯 氧 H++OH-=H2O ![]()
![]()
【解析】
根据题给信息中离子的核外电子排布情况分析元素的种类;根据元素的性质分析其最高价氧化物之间的反应,写出离子方程式;根据电子式的书写规则写出阴离子的电子式,并用电子式表示化合物的形成过程。
(1)根据X+和Y-两种离子具有相同的电子层结构,可确定X为第ⅠA族元素,Y为第ⅦA族元素;Z元素原子核内质子数比Y元素原子核内质子数少9个,可知Z元素原子与Y元素原子序数相差9,故Z为Y的前一周期的氧族元素;Y和Z两种元素可以形成四核42个电子的-1价阴离子,该离子为氯酸根离子,则Y为氯,Y为氧,X为钾,故答案为:钾 ;氯;氧;
(2)X最高价氧化物对应水化物氢氧化钾为强碱,Y最高价氧化物对应水化物高氯酸为强酸,反应生成高氯酸钾和水,离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(3)Y-为氯离子,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)K2O为离子化合物,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验
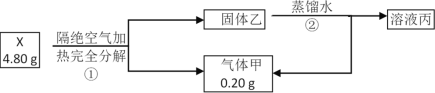
请回答:
(1)X的电子式是____________
(2)固体乙所含元素在元素周期表中的位置____________。
(3)写出X与水反应的化学方程式____________。
(4)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
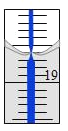
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
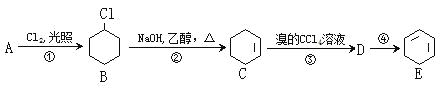
(1)A的名称是_____。
(2)填写以下反应的反应类型:①_____;④_____。
(3)物质C中含有的官能团的名称是_____。
(4)反应②的化学方程式为_____,反应③的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
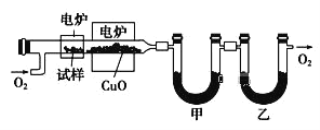
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3(如图Ⅰ)
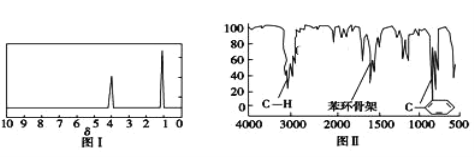
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_____。
(2)X的分子式为_____;X的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
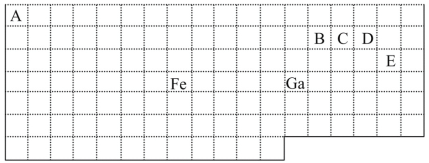
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:浓度的大小顺序为①>②>③
B. HA的电离常数Ka =4.93×1010,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A)
C. NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
D. 已知在相同条件下酸性HF >CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) – c(F) >c(K+ ) c(CH3COO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com