
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
【答案】A
【解析】
酸的电离常数越大,其酸性越强,根据电离常数知,酸性强弱顺序是:醋酸>碳酸的一级电离>硼酸>碳酸的二级电离
A、醋酸的酸性大于碳酸,碳酸根离子的水解程度大于醋酸根离子,所以等物质的量浓度的碳酸钠溶液pH大于醋酸钠溶液,故A正确;
B、碳酸的电离常数大于硼酸,则等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者<后者,故B错误;
C、因为碳酸的一级电离>硼酸>碳酸的二级电离,则碳酸钠和硼酸反应生成碳酸氢钠而不是二氧化碳,所以观察不到有气泡产生,故C错误;
D、醋酸和碳酸钠反应先生成碳酸氢钠,碳酸氢钠再和醋酸反应生成二氧化碳,所以第一步不能观察到有气泡产生,将一滴醋酸溶液滴入碳酸钠溶液中不一定能观察到有气泡产生,故D错误;
故选A。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作不会引起误差的是( )
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂,实验时不小心多加了几滴
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
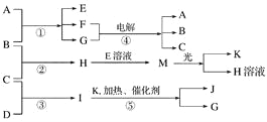
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是合成鬼臼脂的中间体,可通过以下方法合成:
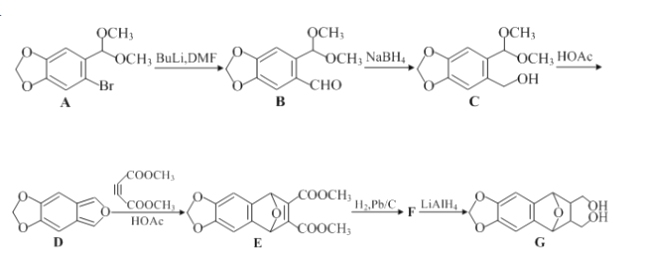
(1)E中的含氧官能团的名称为________、________。
(2)B→C的反应类型为________。
(3)F的分子式为C15H14O7,写出F的结构简式:________。
(4)B的同分异构体X同时满足下列条件。写出符合条件的X的一种结构简式:________。
①属于芳香族化合物;
②在酸性条件下水解后可得三种产物,且每种产物均只含有两种化学环境不同的氢。
(5)已知: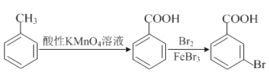 。请以甲苯、BuLi和DMF为原料制备
。请以甲苯、BuLi和DMF为原料制备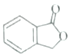 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的综合利用对温室气体的减排以及对减缓燃料危机等具有重要意义。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
该催化重整反应的ΔH=____kJ·mol-1。
(2)CH4-CO2催化重整反应通过热力学计算可得到的图像之一如图。
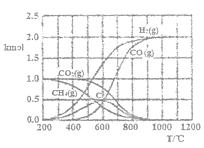
①200—400℃时,主要发生的反应的化学方程式为___。
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是__(用文字表达)。
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
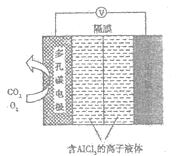
电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2。
+6O2。
反应过程中O2的作用是___。电池的负极反应式为___。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。
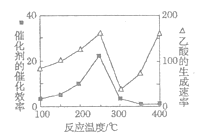
①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为___。
②300~400℃时,乙酸的生成速率升高的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)![]() IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)![]() HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
用热化学方程式表示O3氧化I-生成I2的反应___。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216mol·L-1。
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 35 | 15 | 7 |
①在30℃、pH=4.0条件下,O3的分解速率为___mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是____。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为___(填字母)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
①三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
②碳酸镁与稀硫酸:MgCO3+2H+=H2O+CO2↑+Mg2+
③醋酸与大理石:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
④Fe2+与H2O2(酸性):2Fe2++H2O2+2H+=2Fe3++2H2O
⑤钠与CuSO4溶液:2Na+Cu2+=2Na++Cu
⑥碳酸氢钙溶液与过量烧碱溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
A.①③④⑥B.②③④C.②③④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Iˉ、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀;
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A.(2)中产生的气体可能含有SO2
B.溶液X中一定存在![]() 、
、![]() 、Mg2+
、Mg2+
C.溶液X中一定不存在Fe3+,可能存在Iˉ
D.无法确定溶液中是否含有Na+,需要做焰色反应才能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构。
②Z元素原子核内质子数比Y元素原子核内质子数少9个。
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的元素符号:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式为___________。
(3)Y-的电子式____________。
(4)用电子式表示X、Z形成化合物的过程____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com