
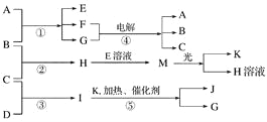
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
【答案】Cl2 NH3 NO NaOH H++ClO-=HClO NH3+H2O![]() NH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
NH3·H2O 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
a、I、e是三种由短周期元素构成的粒子,它们都有10个电子,a单核带一个单位的正电荷,应为Na+;I为四核分子,则I为NH3,e为双核带一个单位负电荷的阴离子,则I为OH-;物质A由a、e构成,则A为NaOH,根据④电解生成A(NaOH),可考虑到氯碱工业,再结合反应①,可知B:Cl2;C:H2;H:HCl;又因H可以与E反应生成M,M光照分解生成氯化氢和K,则推知E:NaClO;F:NaCl;G:H2O;M:HClO;K:O2;再结合⑤即氨的催化氧化,可知D:N2;I:NH3;J:NO。据此解答。
根据以上分析可知A为NaOH,B为Cl2,C为H2,D为N2,E为NaClO,F为NaCl,G为H2O,H为HCl,I为NH3,J为NO,K为O2,M为HClO,则
(1)由上述分析可以知道: B为Cl2,I为NH3,J为NO;
(2)因为物质A由a、e构成,a是Na+、e是OH-,则A为NaOH,故A的化学式是NaOH;
(3)①由上述分析知,H是HCl、E是NaClO、M是HClO,所以H+E(溶液)→M的离子方程式为:H++ClO-=HClO;
②由上述分析知,I是NH3、G是H2O,故I溶于G的离子方程式为:NH3+H2O![]() NH3·H2O;
NH3·H2O;
(4)由分析知反应①的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】Ⅰ.为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示。请依图回答下列问题:

(1)放出一半气体所需要的时间为______;
(2)A、B、C、D各点反应速率快慢的顺序是________;
(3)过氧化氢溶液的初始物质的量浓度为________。(保留2位小数)
Ⅱ.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
(1)某温度下,向2 L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,N2的反应速率为_________, 此时N2 的转化率______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志_____(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
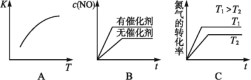
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,图变化趋势正确的是________(填字母序号)。
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应v正 _____v逆。
(5)某生提出,下列方法可以冶炼钢铁:FeO(s)+C(s)=Fe(s)+CO(g) ΔH>0,ΔS>0,上述反应在_____(低温或高温)条件下能自发进行。
(6)现有反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是_______。

A.升高温度
B.降低温度
C.加入催化剂
D.增大压强
E.减小压强
F.充入CO2
G.分离出部分CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是

A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
A. v(NH3)=0.010mol/(L·s) B. v(O2)=0.0010mol/(L·s)
C. v(NO)=0.0010 mol/(L·s) D. v(H2O)=0.45 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向偏铝酸钠溶液中通入过量的CO2:2AlO![]() +CO2+3H2O=2Al(OH)3↓+CO
+CO2+3H2O=2Al(OH)3↓+CO![]()
B.向HNO2溶液中滴加酸性KMnO4溶液:5NO![]() +2MnO
+2MnO![]() +3H2O=5NO
+3H2O=5NO![]() +2Mn2++3OH-
+2Mn2++3OH-
C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH![]() +H++SO
+H++SO![]() =BaSO4↓+NH3H2O+H2O
=BaSO4↓+NH3H2O+H2O
D.向银氨溶液中滴加乙醛溶液并水浴加热:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH
CH3COO-+NH![]() +2Ag↓+H2O+3NH3
+2Ag↓+H2O+3NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液,如图所示。下列说法不正确的是( )
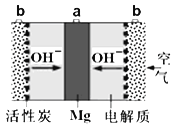
A.正极反应式为:O2+4e-+2H2O=4OH-
B.负极反应式为:Mg-2e-+2OH-=Mg(OH)2
C.电子的移动方向是由a经外电路到b
D.该电池在工作过程中,电解液KOH的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验
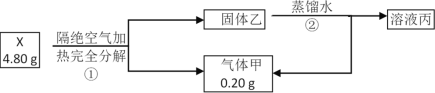
请回答:
(1)X的电子式是____________
(2)固体乙所含元素在元素周期表中的位置____________。
(3)写出X与水反应的化学方程式____________。
(4)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com