
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。
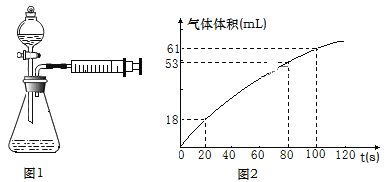
0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。
【答案】除去金属表面的氧化物 0.500 mol·L-1 镁片和铝片与硫酸均反应,镁片表面产生气泡比铝片快 Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O 0.90 0.40 随反应的不断进行,Na2S2O3和H2SO4的浓度逐渐降低,反应速率减小
【解析】
(1) 镁片和铝片的表面可能因被空气中的氧气氧化,为实验的准确性,应除去金属表面的氧化物;由于浓硫酸具有氧化性,常温下能使铝发生钝化,和金属镁反应生成的是二氧化硫,而不是氢气,故应选择0.500 mol·L-1H2SO4;
(2)金属的活泼性是金属本身的性质,镁比铝活泼,故反应速率快;
(3)根据反应原理Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,根据图像得到产生气体的体积,用气体体积的变化量计算出反应速率。
Ⅰ.(1) 甲同学用砂纸打磨镁片和铝片的原因是:镁片和铝片的表面可能因被空气中的氧气氧化,为实验的准确性,应除去金属表面的氧化物;由于浓硫酸具有氧化性,常温下能使铝发生钝化,和金属镁反应生成的是二氧化硫,而不是氢气,故应选择0.500 mol·L-1H2SO4,
答案为:除去金属表面的氧化物;0.500 mol·L-1;
(2) 实验报告中现象为镁片和铝片与硫酸均反应,由于镁比铝活泼,镁片表面产生气泡比铝片快,
答案为:镁片和铝片与硫酸均反应,镁片表面产生气泡比铝片快;
Ⅱ.(3) 用Na2S2O3与H2SO4的反应进行实验,观察到锥形瓶底部有淡黄色浑浊,化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O;根据图2,20秒时,测得反应中产生气体的体积为18mL,则0~20s内反应速率υ1=![]() =0.90mL·s-1,80~100s内产生气体的体积为61mL-53mL=8mL,时间为20s,则反应速率υ2=
=0.90mL·s-1,80~100s内产生气体的体积为61mL-53mL=8mL,时间为20s,则反应速率υ2=![]() =0.40 mL·s-1;产生速率差异的主要原因是:随反应的不断进行,Na2S2O3和H2SO4的浓度逐渐降低,反应速率减小,
=0.40 mL·s-1;产生速率差异的主要原因是:随反应的不断进行,Na2S2O3和H2SO4的浓度逐渐降低,反应速率减小,
答案为:0.90;0.40;随反应的不断进行,Na2S2O3和H2SO4的浓度逐渐降低,反应速率减小。


科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.相同条件下,S(g)+O2(g)=SO2(g) △H1;S(s)+O2(g)=SO2(g) △H2 ,则△H1<△H2
B.由C(石墨)→C(金刚石)△H=+1.9kJ·mol-1,可知金刚石比石墨稳定
C.已知在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ ·mol-1
D.已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
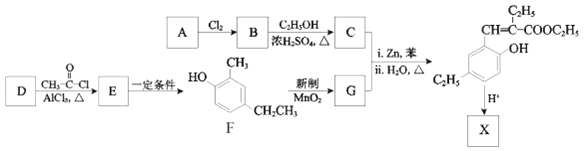
【题目】香豆素类化合物具有芳香气味,是生药中的一类重要的活性成分,主要分布在伞形科、豆科、菊科、芸香科、茄科、瑞香科、兰科等植物中。化合物X是一种香豆素衍生物,可以用作香料,其合成路线如下:
已知:
①RCHO+R’CH2Cl![]() RCH=CHR’
RCH=CHR’
②![]()
![]()
![]()
![]()
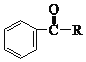
![]()
③![]()
(1)已知A的分子式为C4H8O2,A所含官能团的名称是______。
(2)B生成C反应的化学方程式是______。
(3)G的结构简式是______。
(4)D的分子式是C7H8O,与F互为同系物。则D的结构简式是______。
(5)E可以经多步反应合成F,请写出一条可能的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) ______。
(6)X的分子式是C13H14O2,X与足量NaOH溶液共热的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素 A、B、C、D、E,原子序数依次增大。已知:A 原子的核外电子数与电子层数相等;B 元素原子的核外 p 电子数比 s 电子数少 1 个;C 原子的第一至第四电离能为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D 原子核外所有 p 轨道为全充满或半充满;E 元素的族序数与周期序数的差为 4。
(1)写出 C 单质在 B 单质中燃烧的化学方程式:_______________________________________。
(2)某同学根据题目信息和掌握的知识分析 C 的核外电子排布为![]() 该同学所画的轨道式违背了_______________原理(或规则)。
该同学所画的轨道式违背了_______________原理(或规则)。
(3)用电子式表示 BA3 的形成过程:__________________________。
(4)DE3 中心原子杂化方式为_______________,其空间构型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() H<0,将一定量的
H<0,将一定量的![]() 充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图
充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图![]() 气体颜色越深,透光率越小
气体颜色越深,透光率越小![]() 。下列说法正确的是
。下列说法正确的是
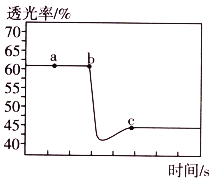
A.a点时化学反应速率为0
B.c点:υ正(NO2)>υ逆(NO2)
C.b点与c点相比,c(NO2)增大,c(N2O4)减小
D.若容器绝热,则平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
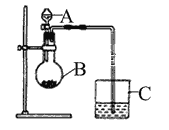
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
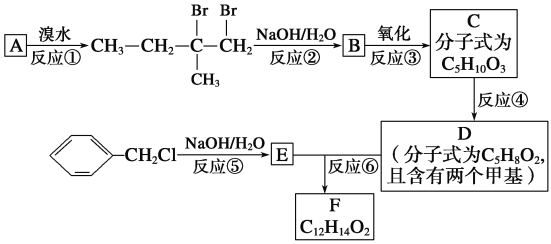
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;
⑥____________________________________________________________________。
(4)F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)煤的利用可以是直接燃烧,也可以是先气化再燃烧 ,下面用等量的C分别按两途径进行反应
a. C(s)+O2(g) = CO2(g) △H =E1
b. C(s) +H2O(g)=CO(g)+H2 (g) △H =E2
H2(g)+![]() O2(g)=H2O(g ) △H =E3
O2(g)=H2O(g ) △H =E3
CO(s)+![]() O2(g)=CO2(g) △H =E4
O2(g)=CO2(g) △H =E4
甲同学认为:煤的气化效率高,所以b途径产生的热量高。乙同学认为,a、b途径产生的热量在理论上应该相同,你认为_____同学说法正确,理由是______________。
(2)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)是否等于 c(M+),要看一元酸HA是强酸还是弱酸。你认为_____同学说法正确,理由是______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com