
【题目】下列说法或表示方法正确的是
A.相同条件下,S(g)+O2(g)=SO2(g) △H1;S(s)+O2(g)=SO2(g) △H2 ,则△H1<△H2
B.由C(石墨)→C(金刚石)△H=+1.9kJ·mol-1,可知金刚石比石墨稳定
C.已知在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ ·mol-1
D.已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
【答案】A
【解析】
A. 相同条件下,①S(g)+O2(g)=SO2(g) △H1;②S(s)+O2(g)=SO2(g) △H2 ,根据盖斯定律,①-②可得S(g)= S(s)△H=△H1-△H2,物质由气态转变为固态属于放热过程,即△H1-△H2<0,则△H1<△H2,故A正确;
B. 由C(石墨)→C(金刚石)△H=+1.9kJ·mol-1,该过程为吸热,说明反应物的能量小于生成物的能量,能量越低越稳定,则可知石墨比金刚石稳定,故B错误;
C. 已知在101kPa时,2gH2为1mol,完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为: H2(g)+![]() O2(g)═H2O(l)△H=-285.8kJ ·mol-1,故C错误;
O2(g)═H2O(l)△H=-285.8kJ ·mol-1,故C错误;
D. 含20.0 g NaOH的稀溶液中氢氧化钠的物质的量为![]() =0.5mol,与稀盐酸完全中和,放出28.7 kJ的热量,1molNaOH与稀盐酸完全中和,放出57.4 kJ的热量;醋酸是弱电解质,电离时要吸收能量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1,故D错误;
=0.5mol,与稀盐酸完全中和,放出28.7 kJ的热量,1molNaOH与稀盐酸完全中和,放出57.4 kJ的热量;醋酸是弱电解质,电离时要吸收能量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1,故D错误;
答案选A。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
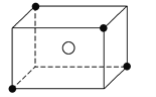
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.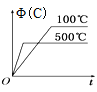 B.
B.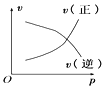 C.
C.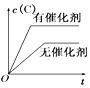 D.
D.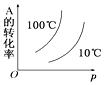
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酸为原料制备胡椒乙酸的合成路线如图所示。回答下列问题:
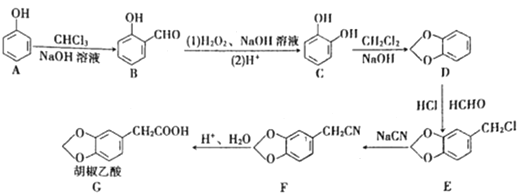
(1)下列关于有机物B的说法正确的是______![]() 填字母
填字母![]() 。
。
a.能与FeCl3溶液发生显色反应 b.核磁共振氢谱中只有3组峰
c.能发生银镜反应 d.能与溴水发生加成反应
(2)有机物C的名称是______,C→D的反应类型是______。
(3)胡椒乙酸(G)的分子式为______,G所含官能团的名称为______。
(4)E生成F的化学方程式为______。
(5)W是G的芳香族化合物同分异构体,0.5molW与足量碳酸氢钠溶液反应生成1molCO2,则W的结构共有______(不含立体异构)种,其中苯环上有2个取代基,且核磁共振氢谱有5组峰的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G的合成路线如下:
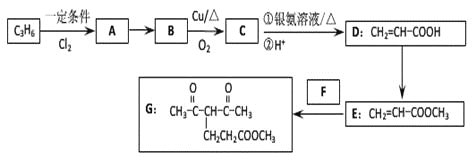
(1)D中含氧官能团的名称为_________,1 molG发生加成反应最多消耗_______mol H2 。
(2)去掉E中含有少量D的试剂和操作是________________________________________;下列有关E的说法正确的是_____________(填字母序号)。
A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:________________________________________
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为______________________。
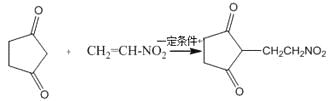
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式_________________。
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。
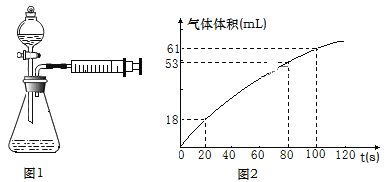
0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com