
����Ŀ���л���A���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
��1����ȡA 9.0 g������ʹ�������������ܶ�����ͬ������H2��45���� | ��ͨ��������գ� ��1��A����Է�������Ϊ_________ |
��2����9.0 g A��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4 g��13.2 g�� | ��2��A�ķ���ʽΪ________________ |
��3����ȡA 9.0 g����������NaHCO3��ĩ��Ӧ������2.24 LCO2����״�������������������Ʒ�Ӧ������2.24 L H2����״������ | ��3���ýṹ��ʽ��ʾA�к��еĹ�����__________��____________�� |
��4��A�ĺ˴Ź�����������ͼ�� | ��4��A�к���______����ԭ�ӡ� |
��5������������A�Ľṹ��ʽΪ_____ ___�� | |
���𰸡���1��90 ��2��C3H6O3 ��3����COOH ��OH ��4��4 ��5�� ![]()
��������
�����������1��A�����ܶ�����ͬ������H2��45 ������A����Է�������Ϊ45��2��90��
��2�� 9.0gA�����ʵ�����0.1mol����������O2�г��ȼ�գ���ʹһ��������λ���ͨ��Ũ��������ˮ�֣�����5.4g����n��H2O����5.4g��18g/mol��0.3mol��ͨ����ʯ������CO2������13.2g����n��CO2����13.2g��44g/mol��0.3mol�����к���OԪ�ص����ʵ�����n��O������9.0g-0.3mol��2��1g/mol-0.3mol��12g/mol����16g/mol��0.3mol������A����ʽΪC3H6O3��
��3����ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״������n��CO2����2.24L��22.4L/mol��0.1mol,˵��һ�������к���һ���Ȼ����������������Ʒ�Ӧ������2.24LH2����״������n��H2���� 2.24L��22.4L/mol��0.1mol�����������Ȼ����ǻ������Է����û���Ӧ��������������֤�������л�����һ���ǻ���A�����������ŵ������Ȼ����ǻ���
��4������A �ĺ˴Ź�������ͼ��֪���ڸ����ʷ����к���4�ֲ�ͬ����ԭ�ӣ���������1��1��1��3����5����������������֪A�ṹ��ʽ��![]() ��
��


 ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�ص���±ˮ(��Cl����Br����Na����Mg2��)��װ����ͼ��ʾ(a��bΪʯī�缫)������˵���У���ȷ����

A����ع���ʱ��������ӦʽΪO2��2H2O��4e��===4OH��
B�����ʱ��a�缫��Χ���ȷŵ����Cl����������Br��
C�����ʱ����������·���ǣ������D�����·�D�������D����Һ�D�������D������
D������������ģ������������0.02 g H2ʱ��b����Χ�����0.02 g H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��仯���ﳣӦ�����л���ķ�Ӧ�ͷ���֮�У�ij�����廯����A����ʽΪC8H10O2 ,Ϊ�ⶨ��ṹ�����·�����
��1��Ϊȷ���ǻ��ĸ�������1mol A�������Ʒ�Ӧ��������22��4L(��״����)��˵��A�����к��ǻ�
����
��2���˴Ź���������ʾA��3���壬�����֮��Ϊ1��2��2�������ʵĽṹ��ʽΪ ��
��3��A��Cu���¿ɱ��������������л���B��B����Է���������AС4����д����Ӧ�ķ���ʽ ��
��4���л���F���л���B��һ��ͬ���칹�塣1mol F�������Ʒ�Ӧͬ����������22��4L(��״����)����F��ʹ�Ȼ�����Һ����ɫ����д��������������л���F�Ľṹ��ʽ ��ֻд��һ�ּ��ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����̼ԭ�Ӻ���ԭ�Ӹ�����Ϊ3��4����������ˮ��Ӧȴ��ʹ����KMnO4��Һ��ɫ���������ܶ�����ͬ״���¼����ܶȵ�7��5������������ʱ���巴Ӧ������������һ�������л�������ǣ� ��
A. CH��C��CH3![]() B. CH2�TCHCH3
B. CH2�TCHCH3
C. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ������������ѧ��Ӧ���п����̶ȵ���������������ijͬѧ�ⶨ��ѧ��Ӧ���ʲ�̽����Ӱ�����ص�ʵ�顣
��.�ⶨ��ѧ��Ӧ����
��ͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�����֪��S2O32-��2H����H2O��S����SO2����

��1��Ϊ��֤ʵ��ȷ�ԡ��ɿ��ԣ����ø�װ�ý���ʵ��ǰӦ�Ƚ��еIJ�����_______________������ͼװ����ʾ��ʵ����Ʒ�������⣬����Ҫ�����ʵ��������__________��
��2������2 minʱ�ռ���224 mL��������ɱ�״�������壬�ɼ������2 min��H���ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����________________________��
��3���Լ����ⶨ�÷�Ӧ�Ļ�ѧ��Ӧ���ʵ�����������__________________��дһ������
��Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ�����أ���Ƶ�ʵ�鷽�����±�������֪ I2��2S2O32-===S4O62-��2I��������Na2S2O3��Һ��������
ʵ�� ��� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | Vx | t3 |
��4����ʵ����е�Ŀ����_____________������Һ��������____________��
��5������Vx=_______mL���Ƚ�t1��t2��t3��С�����Ʋ��ʵ����ۣ� ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵ����ͨ�����ЧӦ���߹⻯ѧЧӦֱ�Ӱѹ���ת���ɵ��ܵ�װ�á�������е�����������ͭ���ࡢ�������Ȼ����
��1����̬��ͭ�����е���ռ�ݵ�ԭ�ӹ����ĿΪ____________��
��2������̬��ԭ�Ӽ۲�����Ų�ʽд��4s24px24py4������Υ����____________��
��3������ͼ��ʾ̼�������Ԫ�ص��ļ������ܱ仯���ƣ����б�ʾ��������____________(����)��
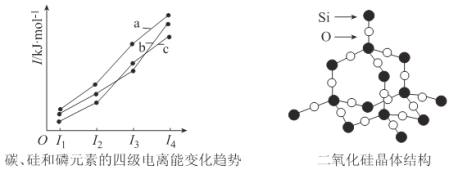
��4����������ɶ��������Ƶã��������辧��ṹ������ͼ��ʾ���ڶ������辧���У�Si��O
ԭ�������ӵ���С��Ϊ____________Ԫ������ÿ��Oԭ������____________����С����
��5������Ԫ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԡ���Ȼ���к���Ԫ�ص�������һ����Ȼ��أ��仯ѧʽд��Na2B4O7��10H2O��ʵ�������Ľṹ��Ԫ��������H3BO3������[B(OH)4]-���϶��ɵ�˫��Ԫ����Ӧ��д��Na2[B4O5(OH)4]8H2O.��ṹ��ͼ��ʾ�����������ӿ��γ���״�ṹ��


���þ����в����ڵ���������____________(��ѡ����ĸ)��
A�����Ӽ�B�����ۼ�C��������D�����»���E.���
��������ͨ��____________�����γ���״�ṹ��
��6��������(GaN)�ľ���ṹ��ͼ��ʾ��������N��Gaԭ�ӵĹ���ӻ������Ƿ���ͬ____________(����������������)���жϸþ���ṹ�д�����λ����������____________��

��7��ij�������������������ͭ�������ﰴһ�������ۺ϶��ɣ�������������ᄃ���ṹ����ͼ��ʾ�������ʵĻ�ѧʽΪ____________����֪�þ����ܶ�Ϊ7.4g/cm3�������߳�Ϊ4.3��10-10m����������ԭ������Ϊ____________(����С�����һλ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص�����ת����Ҫ��ʽ�� ���ڵ����е�����������Ϊ ����a��b ��ʾ����
��2��������ӦʽΪ ��
��3���缫����Ʋ�����ԭ���� ��
��4���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ���������
�ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�w.w.w..c.o.m��2Li��H2![]() 2LiH ��LiH��H2O��LiOH��H2��
2LiH ��LiH��H2O��LiOH��H2��
�ٷ�Ӧ���е��������� ��
����֪LiH�����ܶ�Ϊ0.82g/cm3���������224L����״����H2�����ɵ�LiH����뱻���յ�H2�����Ϊ ��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80����������ͨ�����ӵ����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��

������Ͳ��ȡ50 mL 0.25 mol/L���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol/L NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
����NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
��1��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ(�к�����ֵΪ57.3 kJ/mol)��_____��
��2������NaOH��Һ����ȷ������________(������ѡ��)��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________(������ѡ��)��
A�����¶ȼ�С�Ľ��� B.�ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β���������ؽ���
��4������50mL0.55mol/LHCl��50 mL 0.55 mol/L NaOH��Һ��Ӧ�ⶨ�к��ȣ��������к��ȣ�
(��ƫ�� ƫС ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣���ش��й����⣺
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��1����������õĽ�����__________�������������뵼����ϵ���__________����ѧ�������ȶ�����__________ ����дԪ�ط��ţ���
��2���������γ��������������Ԫ����_________ ����дԪ�ط��ţ����ֱ�д����Ԫ�ص���������������������������ˮ���ﷴӦ�Ļ�ѧ����ʽ��_________________________��
��3����������ɵĻ���������__________���������ӻ��������������ۻ����������õ���ʽ��ʾ�û�������γɹ���________________________________�������⻯���к���__________���������Ӽ����������Թ��ۼ��������Ǽ��Թ��ۼ������ĵ���ʽ��__________��
��4�����������⻯���зе�ϸߵ���__________��д��ѧʽ��ԭ����_________��
��5�������һ��ʵ�飬�Ƚ��ߢ����������Ե�ǿ����________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com