
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了____________。
(3)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是____________(填标号)。
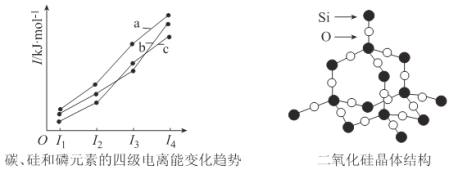
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如右上图所示,在二氧化硅晶体中,Si、O
原子所连接的最小环为____________元环,则每个O原子连接____________个最小环。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构。


①该晶体中不存在的作用力是____________(填选项字母)。
A.离子键B.共价键C.金属键D.范德华力E.氢键
②阴离子通过____________相互结合形成链状结构。
(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型是否相同____________(填“是”或“否”),判断该晶体结构中存在配位键的依据是____________。

(7)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为7.4g/cm3,晶胞边长为4.3×10-10m。则锗的相对原子质量为____________(保留小数点后一位)。
【答案】
(1)14
(2)洪特规则
(3)b
(4)12;6
(5)①C;②氢键
(6)是;GaN晶体中,每1个Ga原子与4个N原子结合,而Ga原子只有3个价电子.故需N原子提供1个空轨道形成配位键
(7)GeO;72.5
【解析】
试题分析:(1)Cu原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子形成Cu+,Cu+基态时电子排布式为1s22s22p63s23p63d10,其电子占据的14原子轨道,故答案为:14;
(2)基态硒原子价层电子排布式写成4s24px24py4,违背了洪特规则,故答案为:洪特规则;
(3)同主族自上而下第一电离能减小,P元素3p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故Si的第一电离能最小,由图中第一电离能可知,c为Si,P原子第四电离能为失去4s2能中1个电子,为全满稳定状态,与第三电离能相差较大,可知b为P、a为C,故答案为:b;
(4)在二氧化硅晶体,Si、O原子所连接的最小环为12元环;可以看作在晶体硅中每个Si-Si键之间连接O原子,晶体Si中每个Si原子形成4个Si-Si键,由图可知每2个Si-Si键可以形成2个六元环,而4个Si-Si键任意2个可以形成6种组合,则每个Si原子连接十二元环数目为6×2=12,则每个O原子连接6个最小环故答案为:12;6;
(5)①该晶体属于离子晶体,含有离子键,在阴离子中含有共价键,该阴离子通过氢键相互结合形成链状结构,水分子间存在范德华力,故选C。
②该阴离子通过氢键相互结合形成链状结构,故答案为:氢键;
(6)根据氮化嫁(GaN)的晶体结构图,晶胞中1个Ga与4个N原子相结合,则1个N也与4个Ga原子相结合,Ga原子采取sp3杂化,则N原子也采用sp3杂化,杂化类型相同;晶胞中1个Ga与4个N原子相结合,而Ga原子中含有3个价电子,Ga提供1个空轨道与N原子提供的孤对电子形成配位键,故答案为:是;晶胞中1个Ga与4个N原子相结合,而Ga原子中含有3个价电子,Ga提供1个空轨道与N原子提供的孤对电子形成配位键;
(7)晶胞中Ge原子数目为4,O原子数目为8×![]() +6×
+6×![]() =4,则化学式为GeO,设锗的相对原子质量为M,则就晶胞质量为:
=4,则化学式为GeO,设锗的相对原子质量为M,则就晶胞质量为:![]() g,则:
g,则:![]() g=7.4g·cm-3×(4.3×l0-8 cm)3,解得M=72.5,故答案为:GeO;72.5。
g=7.4g·cm-3×(4.3×l0-8 cm)3,解得M=72.5,故答案为:GeO;72.5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-![]() H2O+IO- 慢 H2O2+IO-
H2O+IO- 慢 H2O2+IO-![]() H2O+O2+I- 快
H2O+O2+I- 快
下列有关该反应的说法正确的是
A.反应速率与I-浓度有关 B.IO-是该反应的催化剂
C.反应活化能等于98 kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ne的电子层结构相同,试回答:
(1)它们的元素名称是:A B C D E 。
(2)A与B的化合物以 键结合,写出BA4的电子式 ;
C和E的化合物以 键结合,写出E2C的电子式 ;
(3)A、B、C、E的原子半径从大到小的顺序为(写元素符号) ;
(4)写出A和C的化合物(A2C)与C和E的化合物(E2C2)反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeC13发生显色反应,也能和Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为_________ |
(2)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为________________ |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A中含有的官能团__________、____________。 |
(4)A的核磁共振氢谱如下图: | (4)A中含有______种氢原子。 |
(5)综上所述,A的结构简式为_____ ___。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成某复杂化合物,该离子方程式为___________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________。
(4)比较Y、Z气态氢化物的稳定性:__________(用化学式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是

A. 元素X的常见化合价是+1价
B. 若元素Y处于第3周期,它可与冷水剧烈反应
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 元素Y是ⅢA族的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com