
【题目】已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是

A. 元素X的常见化合价是+1价
B. 若元素Y处于第3周期,它可与冷水剧烈反应
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 元素Y是ⅢA族的元素
【答案】B
【解析】试题分析:X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y;A.X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故A正确;B.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故B错误;C.元素X与氯形成化合物时,X的电负性小于Cl元素,所以在二者形成的化合物中X显+1价、Cl元素显-1价,则化学式可能是XCl,故C正确;D.通过以上分析知,Y为第IIIA族元素,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了____________。
(3)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是____________(填标号)。
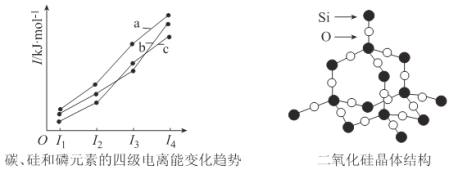
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如右上图所示,在二氧化硅晶体中,Si、O
原子所连接的最小环为____________元环,则每个O原子连接____________个最小环。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构。


①该晶体中不存在的作用力是____________(填选项字母)。
A.离子键B.共价键C.金属键D.范德华力E.氢键
②阴离子通过____________相互结合形成链状结构。
(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型是否相同____________(填“是”或“否”),判断该晶体结构中存在配位键的依据是____________。

(7)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为7.4g/cm3,晶胞边长为4.3×10-10m。则锗的相对原子质量为____________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(普通)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:

合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置a的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 (填正确答案标号)。
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课上,围绕硫的化合物性质进行如下探究,请根据要求回答以下问题。

(1)装置A中反应的化学方程式为________________________________。
(2)装置B用来探究SO2的漂白性,则应装的试剂是________,反应一段时间后,看到的现象是________________;若将Cl2通入B中也能看到同样的现象,则二者在反应原理上________(填“相同”或“不相同”)。
(3)装置C检验SO2具有______性(填“氧化”或“还原”)。装置C试管口棉花团应蘸有_____溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中最活泼的金属是__________,单质能用作半导体材料的是__________,化学性质最稳定的是__________ (填写元素符号)。
(2)表中能形成两性氢氧化物的元素是_________ (填写元素符号),分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:_________________________。
(3)③与⑩组成的化合物属于__________(填“离子化合物”或“共价化合物”)用电子式表示该化合物的形成过程________________________________。①的氢化物中含有__________(填“离子键”或“极性共价键”或“非极性共价键”)的电子式是__________。
(4)⑦和⑩的氢化物中沸点较高的是__________(写化学式)原因是_________。
(5)请设计一个实验,比较⑦⑩单质氧化性的强弱:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:

(1)仪器A为________(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为________;
(2)完善步骤Ⅳ涉及的离子方程式:______C2O42-+ MnO4-+ H+= Mn2++ CO2↑+ ;该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面.
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl-影响
猜想2:配制Na2C2O4标液定容时________;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl-影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)________。
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
无水乙醇性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | —114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: ,对应方程式为(注明反应类型) 。
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) 。
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种 “有刺激性气味”的气体X。你认为这种“有刺激性气味”气体X是 (填化学式)。
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下:
| C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
请回答下列问题:
D中盛放的试剂是 (填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有有机化合物A~E,其转化关系如图所示。

根据以上信息,回答下列问题:
(1)若A为氯代烃,质谱分析测得A的相对分子质量为92.5,且A的核磁共振氢谱图上有三个波峰,其面积之比为1:2:6,则A的结构简式为________,B中所含官能团的名称为________。
(2)请写出下列反应的化学方程式及反应类型。
①A→B:____________________________________________,
反应类型为___________________________________________。
②B+D→E:_________________________________________,
反应类型为__________________________________________。
(3)请写出有机物D的属于酯类的所有同分异构体的结构简式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白:
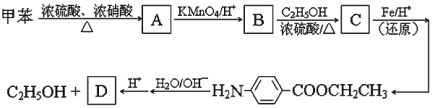
⑴ 写出化合物 B 的结构简式: 。
⑵ 由 B 到 C 的反应类型是 。
⑶ 任意写出两种同时符合下列要求的化合物 C 的同分异构体的结构简式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基;
② 分子中含有 -COO- 结构的基团。
![]()
![]()
![]()
⑷ E、F、G 中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是 (在 E、F、G 中选择,填字母)。
⑸ 一定条件下,化合物 D 发生聚合反应的化学方程式是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com