
����Ŀ������������ȼ�ϵ�ص���±ˮ(��Cl����Br����Na����Mg2��)��װ����ͼ��ʾ(a��bΪʯī�缫)������˵���У���ȷ����

A����ع���ʱ��������ӦʽΪO2��2H2O��4e��===4OH��
B�����ʱ��a�缫��Χ���ȷŵ����Cl����������Br��
C�����ʱ����������·���ǣ������D�����·�D�������D����Һ�D�������D������
D������������ģ������������0.02 g H2ʱ��b����Χ�����0.02 g H2
���𰸡�D
��������
���������A�����Խ����У�����ȼ�ϵ���������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4H++4e���T2H2O��A����B����ԭ��ǿ�������������ȷŵ磬���ʱ��a�缫��Χ���ȷŵ����Br��������Cl�������Ի�ԭ�ԣ�Br����Cl����B������C�����ʱ����������·���ǣ����������·�����������������·��������C����D������ת�Ƶ������֪�������������0.02g H2ʱ��b ����Χ�����0.02g H2��D��ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�ؾ�����Դ�㷺���۸�����������Ѻá���ȫ�ɿ����ص㣬�ر��ʺ��ڹ̶�ʽ���ģ����Ӧ�õ�����һ����Na2SO4ˮ��ҺΪ���Һ�������ӵ���ܷ�ӦΪ��NaTi2(PO4)3 +2Na2NiFeII (CN)6 ![]() Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(ע������P�Ļ��ϼ�Ϊ+5��Fe���ϱ�II��III�������̬)������˵������ȷ����( )
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(ע������P�Ļ��ϼ�Ϊ+5��Fe���ϱ�II��III�������̬)������˵������ȷ����( )
A���ŵ�ʱNaTi2(PO4)3������������ԭ��Ӧ
B���ŵ�ʱ���������е�Na������缫������Һ��ͬʱ��Һ�е�Na��Ƕ�뵽����������
C����������������ӦʽΪ��2NaNiFeIII(CN)6��2Na����2e����2Na2NiFeII (CN)6
D���õ���ڽϳ�ʱ���ʹ�ù����е������Һ��Na+��Ũ�Ȼ������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij�л���Ľṹ��ʽ��ͼ��ʾ�����ڸ��л����˵������ȷ����

A�����л���Ļ�ѧʽΪC20H14O5
B�����л�������е��������������ܹ�ƽ��
C�����л���ɷ����ӳɡ�ȡ������������ȥ�ȷ�Ӧ
D��1 mol���л���������NaOH��Һ��ַ�Ӧ������NaOH�����ʵ���Ϊ500mol
II.��ԭ��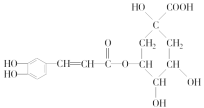 ��һ�ֿ�����ҩ�������ͼ��ʾ��ת����ϵ��
��һ�ֿ�����ҩ�������ͼ��ʾ��ת����ϵ��

��1����ԭ���еĺ�����������������________��
��2��B�ķ���ʽ��__________________��
��3��C�����������ܷ���������Ӧ����C��D�Ļ�ѧ����ʽ��_______________��
��4�������ᱽ�����Ľṹ��ʽ��_______��
��5��1 mol A��������H2��Ũ��ˮ���ã���������H2________mol��Ũ��ˮ________mol��
��6��F��A��ͬ���칹�壬F�ֱ���̼��������Һ������Cu(OH)2��Һ��Ӧ����������ɫ������������ֻ������ȡ�������Һ˴Ź������ױ������л�������8�ֲ�ͬ��ѧ�������⡣
����������������F��________�ֿ��ܵĽṹ��
����F������NaOH�ڳ����������ʵ���֮��1��2��ȫ��Ӧ���仯ѧ����ʽΪ________ (��д1��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش��������⣺
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ��___________��
��2��H3PO2��NaH2PO2���ɽ���Һ�е������ӻ�ԭΪ�����ʣ��Ӷ������ڻ�ѧ������
��(H3PO2)�У���Ԫ�صĻ��ϼ�Ϊ___________��
������(H3PO2)���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1������������Ϊ��___________(�ѧʽ)��
��NaH2PO2�� ���λ�����ʽ�Σ�___________������Һ��___________��(������ԡ��������ԡ������ߡ������ԡ�)��
��3��H3PO2�Ĺ�ҵ�Ʒ��ǣ�������(P4)������������Һ��Ӧ����PH3�����Ba(H2PO2)2�������������ᷴӦ��д������������������Һ��Ӧ�Ļ�ѧ����ʽ___________��
��4��(H3PO2)Ҳ����ͨ�����ķ����Ʊ�������ԭ����ͼ��ʾ(��Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��):

��д�������ĵ缫��Ӧʽ___________��
�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ��___________��
�����ڲ��á����ҵ����������Ʊ�H3PO2���������ҵ����������������ҵ�ϡ������H3PO2ϡ��Һ���棬����ȥ���������Ʒ��֮�����Ĥ���Ӷ��ϲ������������Ʒ�ң���ȱ����___________�����������ʲ�����ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pAg=-lg(Ag+)��Ksp(AgCl)=1��10-12����ͼ����10mLAgNO3��Һ������0.1mol![]() L-1��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ������仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ����[��ʾ��Ksp(AgCl) ��Ksp(AgI)]
L-1��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ������仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ����[��ʾ��Ksp(AgCl) ��Ksp(AgI)]

A����ͬ�¶��£�AgCl�ڴ�ˮ����NaCl��Һ�е��ܽ�����
B��ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0.1mol![]() L-1
L-1
C��ͼ��x�������Ϊ��100��6��
D����0.1mol![]() L-1��NaCl��Һ����0.1mol
L-1��NaCl��Һ����0.1mol![]() L-1��NaI��Һ��ͼ���Ϊ���߲���
L-1��NaI��Һ��ͼ���Ϊ���߲���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ֽ�1 mol H2O2�ų�����98 kJ���ں�����I-����Һ��,H2O2�ֽ�Ļ���Ϊ:
H2O2+I-![]() H2O+IO- �� H2O2+IO-
H2O+IO- �� H2O2+IO-![]() H2O+O2+I- ��
H2O+O2+I- ��
�����йظ÷�Ӧ��˵����ȷ����
A����Ӧ������I-Ũ���й� B��IO-�Ǹ÷�Ӧ�Ĵ���
C����Ӧ��ܵ���98 kJ��mol-1 D��v(H2O2)=v(H2O)=v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]() ����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)
����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)![]()
![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____________________����֪��K300����K350������÷�Ӧ��______�ȷ�Ӧ��
��2����ͼ��ʾNO2�ı仯��������_______����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��_______________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͬ�������������ʣ����״����Ҵ����Ҷ���������������ϩ����ȫȼ�ղ���CO2�����ʵ����Ӵ�С����Ϊ��______________________________________������ţ���
��2�������л�����������ȷ�������� ��
A. 1,3,4-���ױ�
1,3,4-���ױ�
B. 2-��-2-�ȱ���
2-��-2-�ȱ���
C. 2-��-1-����
2-��-1-����
D. 3-��-1-��Ȳ
3-��-1-��Ȳ
��3�����л�������ˮ�е��ܽ�ȣ��Ӵ�С�����д���Ϊ__________________������ţ�
��HOCH2CH2CH2OH ��CH3CH2CH2OH ��CH3CH2COOCH3 ��![]()
��4�����������л��ﻹԭ�Ե���ʵΪ�� ��
A����ȩ����������Ӧ
B����ȩ�����Ƶ�������ͭ����Һ��Ӧ
C����ͪ�����������ӳ�
D����ϩʹ����KMnO4��Һ��ɫ
E����ϩʹ��ˮ��ɫ
F���Ҵ���ͭ�Ĵ�������������������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
��1����ȡA 9.0 g������ʹ�������������ܶ�����ͬ������H2��45���� | ��ͨ��������գ� ��1��A����Է�������Ϊ_________ |
��2����9.0 g A��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4 g��13.2 g�� | ��2��A�ķ���ʽΪ________________ |
��3����ȡA 9.0 g����������NaHCO3��ĩ��Ӧ������2.24 LCO2����״�������������������Ʒ�Ӧ������2.24 L H2����״������ | ��3���ýṹ��ʽ��ʾA�к��еĹ�����__________��____________�� |
��4��A�ĺ˴Ź�����������ͼ�� | ��4��A�к���______����ԭ�ӡ� |
��5������������A�Ľṹ��ʽΪ_____ ___�� | |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com