
【题目】已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol![]() L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]

A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol![]() L-1
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol![]() L-1的NaCl溶液换成0.1mol
L-1的NaCl溶液换成0.1mol![]() L-1的NaI溶液则图像变为虚线部分
L-1的NaI溶液则图像变为虚线部分
【答案】C
【解析】
试题分析:A.AgCl在水中存在如何平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol
Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol![]() L-1,即原AgNO3溶液的物质的量浓度为1 mol
L-1,即原AgNO3溶液的物质的量浓度为1 mol![]() L-1,故B错误;C.x点c(Ag+)=10-6 mol
L-1,故B错误;C.x点c(Ag+)=10-6 mol![]() L-1,一般认为溶液中离子浓度小于10-6 mol
L-1,一般认为溶液中离子浓度小于10-6 mol![]() L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol
L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol![]() L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol
L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol![]() L-1的NaCl换成0.1mol
L-1的NaCl换成0.1mol![]() L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。
L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。


科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→ 2CO2+3H2O,电池示意如图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++ O2+ 4e-= 2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式 。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是_____________ _ ______。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2 + Hg=Cu2HgI4(玫瑰红)+ 2Cu,产物Cu2HgI4中Cu元素显____价。当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现反应条件不同,反应速率不同。请
回答下列问题:
(1)在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。
①加入硫酸铜溶液后可以加快氢气生成速率的原因是 。
②实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4 溶液起相似作用的是 。
③为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
请完成此实验设计,其中:V1= ,V6= 。
该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
(2)该同学为探究其它因素对锌与稀硫酸反应速率的影响,又做了以下实验,记录数据如下,回答下列问题:
①由实验可推知,反应物的总能量 产物的总能量(填“<”“>”“=”)。
②实验2和5表明, 对反应速率有影响。
③实验4和5表明, 对反应速率有影响, 反应速率越快,
能表明同一规律的实验还有 (填实验序号)。
④本实验中影响反应速率的其他因素还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
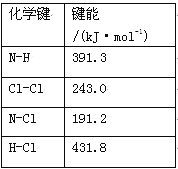
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中,正确的是

A.电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Cl-,而不是Br-
C.电解时,电子流动路径是:负极―→外电路―→阴极―→溶液―→阳极―→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )

A.N4分子属于一种新型的化合物 B.N4分子中只含有非极性键
C.1molN4分子所含共价键数为4NA D.N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com