
【题目】工业上制取纯硅的主要反应:SiCl4 + 2H2 ![]() Si + 4HCl。该反应中,被还原的物质是______(填化学式),作为还原剂的物质是______(填化学式);若反应中生成了1 mol Si,则消耗H2 ______mol。
Si + 4HCl。该反应中,被还原的物质是______(填化学式),作为还原剂的物质是______(填化学式);若反应中生成了1 mol Si,则消耗H2 ______mol。
科目:高中化学 来源: 题型:
【题目】2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g)![]() PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
A. 0.40 mol B. 小于0.20 mol C. 0.20 mol D. 大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A,B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。
(1)用电子式表示A与B两种元素构成的两种化合物分别为__________________和__________________,前者只有__________键;后者既有________键,又有________键。
(2)A的氢化物的电子式为_______,其中含有________键,它与水反应的化学方程式为____________。
(3)元素B的气态氢化物的电子式为___________________________________________,该分子中的键属于________(填“极性”或“非极性”)键,该氢化物与H+形成的键属于________。
(4)元素A的最高价氧化物的水化物的电子式为____________,其中既有________键,又有________键。
(5)B元素的单质有__________和__________,二者互称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围_____________________。
(3)若要使右室反应开始时V正<V逆,x的取值范围_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1871年门捷列夫最早预言了类硅元素锗,1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;2.GeCl4易水解,在浓盐酸中溶解度低。

(1)简述步骤①中提高酸浸效率的措施___________(写两种)。
(2)步骤②操作A方法是___________。
(3)步骤③中的物质在___________(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是___________。
(5)写出步骤⑤的化学方程式___________。写出步骤⑦的化学方程式___________。
(6)请写出一种证明步骤⑦反应完全的操作方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产氮化硅陶瓷反应为3SiCl4+2N2+6H2![]() Si3N4+12HCl,有关该反应说法正确的是
Si3N4+12HCl,有关该反应说法正确的是
A. SiCl4是氧化剂 B. N2发生还原反应
C. H2被还原 D. N2失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+和Cl-,实验室设计下列方案对废液[体积为1 L,c(H+)=0.10 mol/L]进行处理,以回收金属并测定含量。
回答下列问题:

(1)实验中操作I、II、III的方法相同,其所用的玻璃仪器有烧杯、漏斗、____。
(2)“还原”步骤时发生的离子方程式为____(只需写出其中任意一个),“氧化”步骤的目的是____。
(3)操作III后得到可排放废水中含有的溶质主要是____(填化学式)。
(4)进行如下实验测定:
①将操作II得到的固体II溶于足量稀盐酸,充分反应,得到的固体质量为9.6 g。
②将操作III得到的固体III进行充分灼烧,得到的红棕色固体质量为40.0 g。
原溶液中Fe3+的物质的量浓度是多少___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
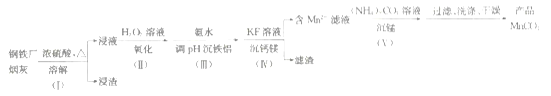
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
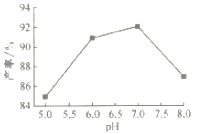
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。

②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
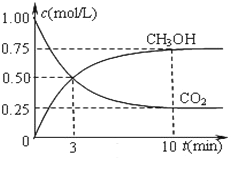
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·S);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
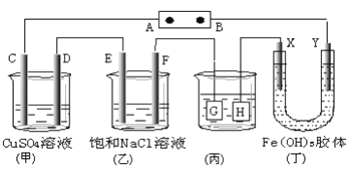
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为_________________________
(2)欲用(丙)装置给铜镀银,银应该是 _____电极(填G或H)
(3)(丁)装置中Y极附近红褐色变_______(填深或浅)
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com