
| A、氢氧化钡晶体与氯化铵固体反应 |
| B、甲烷燃烧 |
| C、氢氧化钠与稀硝酸反应 |
| D、实验室用Zn与稀硫酸制备氢气 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,则H2燃烧热为241.8kJ?mol-1 |
| B、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| C、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| D、由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ?mol-1① BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1②可得反应C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇燃烧是生成物总能量高于反应物总能量的反应 | ||
| B、稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为△H=-57.3 kJ/mol | ||
| C、2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-QkJ/mol可以表示H2S的燃烧热. | ||
D、高温下,某反应达到平衡,平衡常数为K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1H2SO4溶液 |
| B、2 mol?L-1NaOH溶液 |
| C、2 mol?L-1MgSO4溶液 |
| D、硅酸溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
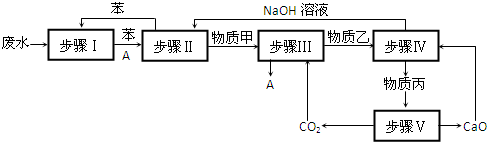
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com