
����Ŀ����������Խ��Խ�����ӣ�ij��������Ϊ���ٻ�����Ⱦ�������Դ�������ʡ����ѳ����ȼ���״���������������������Ҫ�����������£���FeTiO3��TiΪ+4�ۣ�

����������ȷ����
A. ��������ֻ��������������Ȼ����漰������ԭ��Ӧ
B. ���Ȼ���ʱÿ����36g��̿����ת��7mol����
C. ���ϳɡ���Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1��1
D. ������������Mg��Ar��������Mg��CO2������
���𰸡�B
��������
ʳ��ˮ�������2Cl-+2H2O![]() C12��+ H2��+ 2OH-�������ռ������������������һ����̼���ϲ����״����������������̼��Ӧ�����Ȼ�����һ����̼���Ȼ��ѣ��Ȼ����뵥��þ�ڸ����·����û���Ӧ�������ѵ��ʡ�
C12��+ H2��+ 2OH-�������ռ������������������һ����̼���ϲ����״����������������̼��Ӧ�����Ȼ�����һ����̼���Ȼ��ѣ��Ȼ����뵥��þ�ڸ����·����û���Ӧ�������ѵ��ʡ�
A. �����������з�Ӧ���漰������ԭ��Ӧ��A����
B. ���Ȼ�����Ӧ��7Cl2+2FeTiO3+6C=6CO+2TiCl4+2FeCl3��ÿ����36g��̿��3mol����ת��7mol������B��ȷ��
C. �ϳɷ�Ӧ��CO+2H2=CH3OH��������Ϊһ����̼����ԭ��Ϊ���������ʵ���֮��Ϊ1��2��C����
D. Mg��CO2��Ӧ����̼���ʣ�����Ӧʵ�����Ȼ��Ѻ�þ�ķ�Ӧ�������ṩ�ȶ�������������̼����ʵ�����������ʣ�D����
��ΪB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڵ���ʵ��ǣ� ��
A������ B���Ȼ��� C������ D��Na2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO | |
����ƽ�ⳣ�� | Ka��1.8��10��5 | Ka1��4.3��10��7 | Ka2��5.6��10��11 | Ka��3.0��10��8 |
�ش��������⣺
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1��������Һ��
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
pH��С�������е�˳����________������ĸ�����д����
��2�������£�0.1mol��L��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����___������ĸ����
A��c��H����
B��c��H������c��CH3COOH��
C��c��H������c��OH����
D��c��OH������c��H����
E��c��H������c��CH3COO������c��CH3COOH��
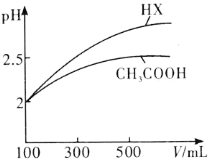
��3�������Ϊ100mL pH��2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��________������ڡ�����С�ڡ����ڡ���CH3COOH�ĵ���ƽ�ⳣ����
��4����״���£���1.12L CO2ͨ��100mL 1mol��L��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ��
��c��OH������2c��H2CO3����________��
��c��H������c��Na������________��
��5��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ�������pH��6������Һ��c��CH3COO������c��Na������________mol��L��1���ȷֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������飨C8H10�����������ϵ��屽��ϩ��C8H8�����䷴Ӧԭ����C8H10��g��![]() C8H8��g����H2��g�� ��H����125kJ��mol��1��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ������������ʵ������õ��������±���
C8H8��g����H2��g�� ��H����125kJ��mol��1��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ������������ʵ������õ��������±���
ʱ�䣯min | 0 | 10 | 20 | 30 | 40 |
n��C8H10����mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n��C8H8����mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������________��
��2�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ����________��������λ��Ч���֣���
��3�������������������䣬��0.40mol H2��g����0.40mol C8H8��g���ϳ�C8H10��g��������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
(1)1 mol C2H5OH(l)��ȫȼ������CO2(g)��H2O(l)���ų�1 366.8 kJ������________________________________________________________________________
(2)1.7 g NH3(g)������������Ӧ������̬����ų�22.67 kJ��������________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī���缫���������Һ��ϡH2SO4����K2SO4��Һ����CuCl2��Һ����CuSO4��Һ����KOH��Һ
(1)������������������������������(��ͬ������)Ϊ2��1����(�����)__________���������ĵ缫��Ӧʽ����_________________________________________________��
�����ĵ缫��Ӧʽ����_________________________________________________��
�ܷ�Ӧ�Ļ�ѧ����ʽ����_________________________________________________��
(2)�����������������������������Һ������ǿ����____________________�� (�����)��
(3)һ���缫������������һ���缫�ݳ��̼�����ζ�������_______(�����)��
�������ĵ缫��Ӧʽ��___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǻ�̼Ԫ�ص����ʣ���ʯī����һ����̼�����ɱ�����̼�ᣬ��̼��ƣ����Ҵ����������ڵ��ʵ���______������ţ���ͬ���������������������______�������ε���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʡ������£�AΪ���壬B��C��Ϊ���塣�����˵������£����ǿ�����ͼ���з�Ӧ������˵������ȷ����
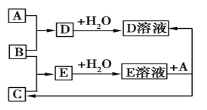
A. A��B��C������Ԫ�ص���������Ԫ���γɵĻ���������������������������
B. A��B��C����һ�ֽ�����ΪB
C. ���E��Һ��һ��ǿ�ᣬ��E��ҺΪ����
D. A��B��C������Ԫ�ص���������Ԫ���γɵĻ����������������һ�����Ǽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���1.00molN2(g)��3.00molH2(g)�����һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3(g)��ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
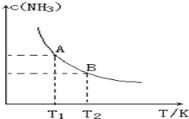
��1�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1___________K2(���������������=��)���ʱ��H___________0(���������)��
��2���÷�Ӧ��T1�¶���5.0min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ_________,N2��ת����___________��
��3��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1=______________��
��4��T1�¶�ʱ������ø�¯��c(N2)=0.5mol/L��c(H2)=0.5mol/L��c(NH3)=0.5mol/L������������£��÷�Ӧ�Ƿ���ƽ��״̬___________(���ǻ��)����ʱ��Ӧ������v��___________v��(�������=)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com