
【题目】在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
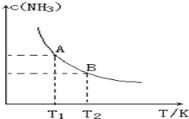
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0(填“>”或“<”)。
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_________,N2的转化率___________。
(3)T1温度下该反应的化学平衡常数K1=______________。
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。
【答案】><0.008mol/(L·min)40%18.3否>
【解析】
(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数关系K1>K2,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0;
(2)将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): 1 3 0
变化量(mol): n 3n 2n
平衡量(mol): 1-n 3-3n 2n
所以![]() ,解得n=0.4。故v(N2)=
,解得n=0.4。故v(N2)=![]() =0.008mol/(L·min),N2的转化率=
=0.008mol/(L·min),N2的转化率=![]() ;
;
(3)根据(2)中分析可知T1温度下该反应的化学平衡常数K1=![]() ;
;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,则此时浓度商Qc=![]() ,未处于平衡状态,反应向正反应进行,则v正>v逆。
,未处于平衡状态,反应向正反应进行,则v正>v逆。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)

下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) ![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
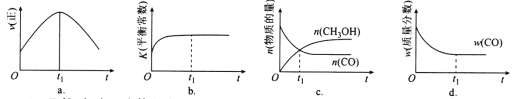
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) ![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=____________________________。
CH3OH(g)的平衡常数K=____________________________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
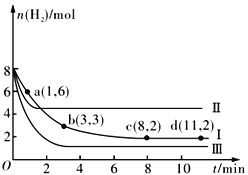
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
B. 常温下,224 mL H2O中所含氢氧键的数目约为0.02NA
C. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关仪器“0”刻度位置的叙述正确的是()
A. 在量筒的上方 B. 在体温表的最下端.
C. 在托盘天平游码标尺的最左端 D. 在托盘天平刻度尺的右边
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com