
【题目】(1)CH2Cl2的空间构型为______;聚丙烯的链节为______。
(2)比较Li+和H-半径大小r(Li+)____r(H-)(填“>”或“<”),并说明理由____。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
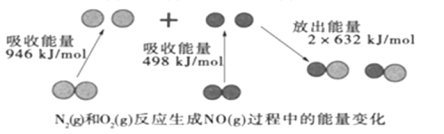
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出)。
![]()
已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
(1)甲元素在周期表中的位置为______________。
(2)丙、丁可形成AB2型化合物,其化学式为________。
(3)丙是自然界中形成化合物种类最多的元素,则丙是________(填名称),其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是______________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,则丁是________(填元素符号),写出这些化合物中任意两种符合以下条件的化学式______________________
(①原子个数比为1∶2;②分子中价电子总数为偶数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物说法正确的是
A.硫粉和铜粉共热时反应生成黑色的硫化铜
B.浓硫酸具有吸水性,可以干燥H2S、SO2等气体
C.FeSO4可用于生产防治缺铁性贫血的药剂
D.某溶液中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构或性质的描述,不正确的是( )
A. C4H9OH发生催化氧化反应,可生成3种有机产物
B. 光照下,Cl2可在甲苯的苯环上发生取代反应
C. 乙二醇和乙二酸可发生缩聚反应,生成高分子化合物
D. 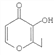 的分子式为C7H8O3
的分子式为C7H8O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
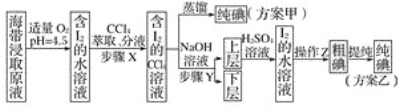
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O,M=154.0g·mol-1)俗称吊白块,易溶于水,微溶于乙醇,在120℃以上易分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
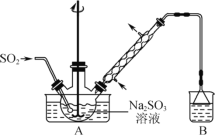
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80℃~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液经结晶、抽滤、洗涤等操作后制得粗产品。
(1)步骤2中加入锌粉反应时会有Zn(OH)2生成,写出发生反应的化学方程式_____________;为防止生成的Zn(OH)2覆盖在锌粉表面阻止反应进行,可采取的措施是_____________。
(2)下列说法中不正确的是_____________。
A.装置B的作用是吸收尾气
B.该实验的加热方式最好选用水浴加热
C.步骤2抽滤的滤渣成分只有Zn(OH)2固体
D.步骤3得到的产品可以在烘箱中高温烘干
(3)如图装置,经过一系列操作完成步骤3中的结晶和洗涤操作。请选择合适的字母,按正确的操作顺序补充完整(洗涤操作只需考虑一次):_____→固液转移至布氏漏斗→开抽气泵→c→f→________→_________→_________→________→d→关抽气泵。_____________
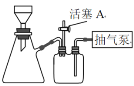
a.将滤液蒸发至大量晶体出现
b.将滤液真空浓缩,冷却结晶
c.关闭活塞A
d.打开活塞A
e.加乙醇洗涤
f.确认抽干
(4)将0.5000g样品充分加热分解,释放出的HCHO用36.00mL0.1000mol·L-1KMnO4溶液吸收(不考虑SO2的影响,5HCHO+4![]() +12H+=5CO2↑+4Mn2++11H2O),再用0.1000mol·L-1H2C2O4溶液滴定KMnO4溶液,重复实验3次,平均消耗H2C2O4溶液的体积为30.00mL,则样品的纯度为_____________。
+12H+=5CO2↑+4Mn2++11H2O),再用0.1000mol·L-1H2C2O4溶液滴定KMnO4溶液,重复实验3次,平均消耗H2C2O4溶液的体积为30.00mL,则样品的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室铝热反应的实验装置如下:
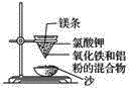
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com