
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:


(1)装置A中反应的化学方程式为________________________________。
(2)使分液漏斗中液体顺利流下的操作是_______________________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___________________________________________。
②丙同学设计的合理实验方案为:A→C→____→____→D→F,其中装置C的作用是_______________,证明亚硫酸的酸性强于次氯酸的实验现象是___________________。
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_______________,称取0.2500 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为_____%(用含c、V的代数式表示,已知:S2O82— +2I— = 2SO42—+I2 ;2S2O32— + I2 = 2S4O62—+2I— )。
【答案】CaSO3+2HCl=CaCl2+SO2↑+H2O 拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞 SO2通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理 B E 除去HCl气体 D中品红不褪色,F中出现白色沉淀 2SO42—— 2e— = S2O82— 54cV
【解析】
(1)亚硫酸根与盐酸反应可生成二氧化硫;(2)从分液漏斗操作规范解答;(3)根据反应中可能混有HCl,之后含有SO2造成干扰,故需依次除去;(4)可利用反应物之间计量关系计算。
(1)盐酸与亚硫酸钙反应生成氯化钙、二氧化硫与水,反应方程式为:CaSO3+2HCl=CaCl2+SO2↑+H2O,故答案为:CaSO3+2HCl=CaCl2+SO2↑+H2O;
(2)分液漏斗使用时应使内外压强平衡,故操作为:拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞;
(3)①次氯酸具有强氧化性、二氧化硫具有还原性,两者可发生氧化还原反应,故答案为:SO2通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理;
②A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸,故答案为:B、E;除去HCl;D中品红不褪色,F中出现白色沉淀;
(4)阳极失电子,化合价升高,对应电极反应为:2SO42——2e— =S2O82—; 由关系式可知S2O82-~2S2O32-,则样品中K2S2O8的纯度为![]() 。
。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C. 甲烷可与水形成氢键
D. 白酒中,乙醇分子和水分子间存在范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是:
A.原子晶体的熔点一定高于离子晶体
B.P4 和 CH4 都是正四面体分子,键角都为 109°28’
C.NaCl 晶体中与每个 Na+距离相等且最近的 Na+共有 6 个
D.C60 气化和 I2 升华克服的作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂用电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:

(1)氯气加压能得到液氯,这利用了氯气______________的物理性质。
(2)在HCl合成塔中是_______气过量。
(3)按照图示流程,为了制得100吨36.5%的盐酸,理论上需氯化钠_______吨。
(4)实验室制备HCl气体的化学方程式:_________。
(5)利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是_______。
(6)氯化氢气体可做美丽的喷泉实验。标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为____,物质的量浓度为___。
(7)某化学兴趣小组进行粗盐(含有少量氯化钙和硫酸镁杂质)提纯实验,请结合实验过程回答下列问题。
步骤一:称取10g粗盐,倒入烧杯中后加入30mL水溶解。为加快溶解速率,可采取的方法是______(任写1种)。步骤二:依次加入稍过量的沉淀剂,充分反应后得到大量沉淀。沉淀剂加入顺序依次为(用化学式表示):__________。步骤三:将混合物进行过滤,取滤液进行下一步操作。步骤四:往滤液中加入适量的____(填试剂名称),调节pH到7(用pH试纸测定),若该试剂不小心加过量,对所得到氯化钠的纯度____(填“有”或“没有”)影响。步骤五:将滤液倒入______中进行加热,等到______时,停止加热,利用余热蒸干。步骤六:晶体转入试剂瓶中待用。在步骤三和五中,玻璃棒的作用依次是____、____。若最终得到的氯化钠固体中还含有微量的NaBr和KCl,更简单的除杂方法是______。已知氯元素的近似相对原子质量为35.5,由![]() 、
、![]() 、
、![]() 构成的11.7gNaCl中含有
构成的11.7gNaCl中含有![]() ___克。
___克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后完成下列问题:

(1)写出三个装置中都发生的化学反应方程式______________________________;写出B的试管中还发生的化学反应方程式____________________________。
(2)装置A、C中长导管的作用是___________________________。
(3)B中双球吸收管中CCl4的作用是__________________;反应后双球管中可能出现的现象是__________;双球管内液体不能太多,原因是__________________。
(4)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是:_______、______。
(5)纯净的溴苯是无色油状的液体,这几种装置制得的溴苯呈红棕色,原因是里面混有_________(书写分子式),滴加__________(书写试剂名称)可以去除杂质。
(6)装置C中的锥形瓶内出现的现象为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素质子数之和的![]() .下列说法正确的是( )
.下列说法正确的是( )
A. 简单离子半径:![]()
B. X与Y形成的二元化合物常温下一定为气态
C. W和R形成的化合物是离子化合物
D. Y与W、Z与W形成的二元化合物都是大气污染物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿的主要成分是MoS2(Mo呈+4价),含少量SiO2以及Re的化合物等杂质。由辉钼矿可制得金属缓蚀剂钼酸钠晶体(Na2MoO4·10H2O)、催化剂Mo2C和氧化剂KReO4,其主要流程如下:

(1)焙烧辉钼矿时发生的反应及反应开始的温度(T)与真空度的关系如下图所示:(真空度P/P0表示反应时的压强与标准大气压之比)

为获得碳化钼,在真空度为0.5的条件下,适宜的反应温度应控制___________。
(2)焙烧时,生成Mo2C的反应中被还原的元素有___________(填元素符号);水洗烧结物时,洗去的物质除Na2S、Na2CO3之外,还有___________。
(3)用 NaClO2氧化MoS2时,MoS2转化为MoO42-和SO42-,写出该反应的离子方程式___________。
(4)已知钼酸钠的溶解度曲线如下图,获得Na2MoO4·10H2O的操作A为___________、___________、过滤。
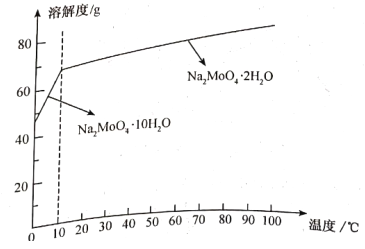
(5)生成KReO4晶体的化学方程式为___________;加入KCl时,同时加入乙醇的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com