
| A、H2O |
| B、H2SO3 |
| C、盐酸 |
| D、NH4C1 |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、已知2NO2?N2O4加压后颜色先变深后变浅 |
| B、在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小 |
| C、在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L |
| D、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是⑤⑥⑦⑧. ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、溶液中一定不含Cu2+ |
| D、剩余固体中一定含Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①=② | B、①<② |
| C、①>② | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | W | |
| 结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
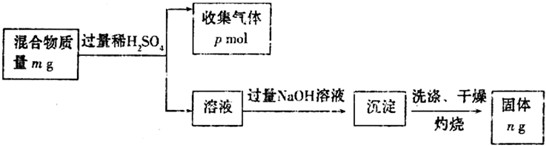
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第7周期第 VA族 |
| B、第6周期第 VB族 |
| C、第7周期第ⅥA族 |
| D、第6周期第 VIIB族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com