
【题目】下列实验操作或分析正确的是( )
A.用湿润的![]() 试纸测盐酸的
试纸测盐酸的![]()
B.检验淀粉是否水解,可以向淀粉溶液中加入稀![]() ,加热一段时间,冷却后加入新制
,加热一段时间,冷却后加入新制![]() ,煮沸,观察是否有红色沉淀生成
,煮沸,观察是否有红色沉淀生成
C.乙醇和乙酸在浓硫酸作用下,酯化制得乙酸乙酯,提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏高
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法不正确的是( )
A.1molO2含有的电子数为16NA
B.0.1mol·L-1碳酸钠溶液含有的CO![]() 数目为0.1NA
数目为0.1NA
C.8gS在足量中氧气完全燃烧转移的电子数为NA
D.标准状况下22.4L甲烷中共价键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用原电池原理可以除去酸性废水中的三氯乙烯和![]() ,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
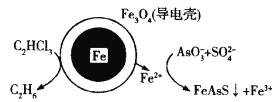
A.纳米铁发生还原反应
B.正极电极反应式:C2HCl3+5H++8e-=C2H6+3Cl-
C.导电壳上电极反应式:![]() +
+![]() +14Fe2++14H+=FeAsS↓+13Fe3++7H2O
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.当电路中有0.4 mol电子转移时,就会有11.2 L乙烷生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津属于沿海城市,下列与海洋有关说法正确的是( )
A.从海水中提取![]() 单质,最后一步电解
单质,最后一步电解![]() 饱和溶液,就可制得金属镁
饱和溶液,就可制得金属镁
B.海水经过一定生产过程可以制造出杀灭病毒的84消毒液
C.从海带中提取碘,含![]() 的溶液可以用酒精萃取
的溶液可以用酒精萃取
D.海水中富集的元素氯在目前已知的元素中电负性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
B. ![]()
![]()
![]() (正反应为放热反应)
(正反应为放热反应)
C. H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol·L-1。
(1)在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为____。(本题计算结果均取三位有效数字)
(2)若使1L饱和氯化钠溶液中Cl-浓度与溶液A中的Cl-浓度相等,则在1LNaCl饱和溶液中还应溶解约___L标准状况下HCl气体(溶液体积变化忽略不计,不考虑氯化钠析出)。
(3)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,6-二甲基苯氧乙酸是合成抗新型冠状病毒药物洛匹那韦的原料之一,其结构简式如图所示,有关2,6-二甲基苯氧乙酸说法正确的是( )
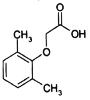
A.该分子所有原子可能处于同一平面B.该分子苯环上一氯代物有3种
C.该分子能使酸性高锰酸钾溶液褪色D.该分子与苯甲酸互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com