
【题目】天津属于沿海城市,下列与海洋有关说法正确的是( )
A.从海水中提取![]() 单质,最后一步电解
单质,最后一步电解![]() 饱和溶液,就可制得金属镁
饱和溶液,就可制得金属镁
B.海水经过一定生产过程可以制造出杀灭病毒的84消毒液
C.从海带中提取碘,含![]() 的溶液可以用酒精萃取
的溶液可以用酒精萃取
D.海水中富集的元素氯在目前已知的元素中电负性最强
科目:高中化学 来源: 题型:
【题目】四水合磷酸锌[Zn3(PO4)2·4H2O],摩尔质量为457g·mol-1,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:
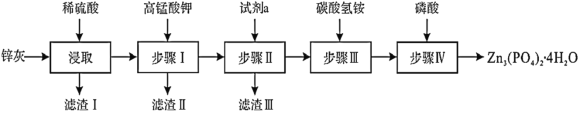
已知:6NH4HCO3+3ZnSO4 ![]() ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
(1)实验前需要将锌灰研磨成粉末状,原因是____。
(2)步骤I中需将溶液pH调至5.1,应选择的最佳试剂是___。(填字母)
a.NaOH b.ZnO c.Ba(OH)2
(3)步骤I滴加KMnO4溶液的目的是___。
(4)步骤Ⅱ中加入的a是___。
(5)步骤Ⅳ的化学方程式是___。
(6)步骤Ⅳ反应结束后得到Zn3(PO4)2·4H2O的操作包括___和干燥。
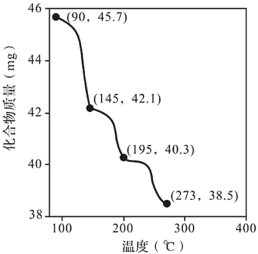
(7)称取45.7mgZn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
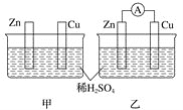
(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或分析正确的是( )
A.用湿润的![]() 试纸测盐酸的
试纸测盐酸的![]()
B.检验淀粉是否水解,可以向淀粉溶液中加入稀![]() ,加热一段时间,冷却后加入新制
,加热一段时间,冷却后加入新制![]() ,煮沸,观察是否有红色沉淀生成
,煮沸,观察是否有红色沉淀生成
C.乙醇和乙酸在浓硫酸作用下,酯化制得乙酸乙酯,提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是煤干馏的产物,可用于制备具有止痛退热效果的冬青油( 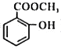 ),合成路线如下:
),合成路线如下:
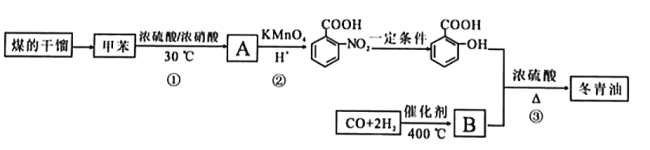
已知: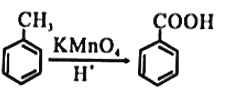
请回答下列问题
(1)煤的干馏是_______________。(填“物理变化”或“化学变化”).
(2)A的结构简式为_______________。反应①的反应类型是_______________。
(3)反应②的反应类型是_______________。
(4)B的官能团名称为_______________。
(5)反应③的化学方程式_______________。
(6)C是冬青油的同分异构体,其苯环上的取代基与冬青油相同,则C的结构简式可能为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
上述反应过程中能量转化形式为光能转化为____能,达平衡过程中至少需要吸收光能___kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2 molNH3,放出92.2kJ热量。已知:

则1 molN—H键断裂吸收的能量约等于_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com