
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
【答案】(1)量筒 温度计
(2)否 金属易导热,热量散失多,导致误差偏大
(3)①-56.8 kJ·mol-1②NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-56.8 kJ·mol-1
(4)无 有
【解析】
试题分析:(1)测定中和热小于用量筒量取酸碱溶液的体积,需要用温度计测量温度,实验尚缺少的玻璃用品是量筒、温度计;(2)金属的导热系数大于玻璃,造成热量散失,误差大,所以不能用金属搅拌器;多次测量,温度取平均值23.4℃,m(HCl) = m(NaOH) = 50g,50 mL0.55 mol·L-1NaOH与50mL.0.5mol·L-1HCl发生中和反应时放出的热量为:Q = Cm(t2 -t1)= 4.18 KJ·℃-1· Kg-1 × 0.1kg × (23.4-20) ℃ = 1.42 KJ,生成1mol水时的反应热为:△H=-1.42 KJ ÷ 0.025 mol = -56.8 KJ/mol。NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l) ΔH = -56.8 kJ·mol-1。中和热是指在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量,KOH与NaOH同为强碱,故对测定结果无影响;醋酸为弱电解质,溶于水发生电离,放出的热量较小。


科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由水煤气合成甲醇。
(1)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。
CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。

(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
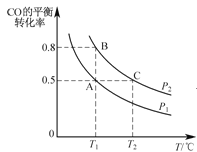
①下列说法不能判断该反应达到化学平衡状态的是_________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_PB(填“>、<、=”).
③若达到化学平衡状态A时,容器的体积为20 L,如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用原电池原理可以除去酸性废水中的三氯乙烯和![]() ,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
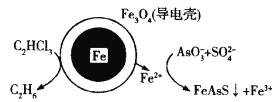
A.纳米铁发生还原反应
B.正极电极反应式:C2HCl3+5H++8e-=C2H6+3Cl-
C.导电壳上电极反应式:![]() +
+![]() +14Fe2++14H+=FeAsS↓+13Fe3++7H2O
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.当电路中有0.4 mol电子转移时,就会有11.2 L乙烷生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
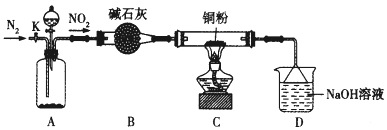
(1)装置A~C中有一处错误,改正的方法是_____________,A中发生反应的两种试剂通常是________。
(2)点燃C处酒精灯比较合适的时机是_____________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:______________。装置D的用途是____________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法______________。(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是![]() ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
稀硫酸 | 氨水 | |
Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
Cu | --- | --- |
请设计一个简单的实验证明甲同学的看法是否正确:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津属于沿海城市,下列与海洋有关说法正确的是( )
A.从海水中提取![]() 单质,最后一步电解
单质,最后一步电解![]() 饱和溶液,就可制得金属镁
饱和溶液,就可制得金属镁
B.海水经过一定生产过程可以制造出杀灭病毒的84消毒液
C.从海带中提取碘,含![]() 的溶液可以用酒精萃取
的溶液可以用酒精萃取
D.海水中富集的元素氯在目前已知的元素中电负性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol·L-1。
(1)在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为____。(本题计算结果均取三位有效数字)
(2)若使1L饱和氯化钠溶液中Cl-浓度与溶液A中的Cl-浓度相等,则在1LNaCl饱和溶液中还应溶解约___L标准状况下HCl气体(溶液体积变化忽略不计,不考虑氯化钠析出)。
(3)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物。
I.实验装置如图所示
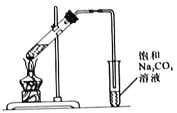
(1)制备乙酸乙酯的化学方程式为_______________。
(2)浓硫酸的作用是_______________。
(3)长导管的作用是_______________。
(4)接收装置还可选择下图中的___________。(填序号).
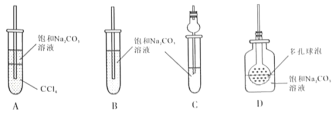
Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液 ① (填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产生 |
实验ii.取振荡后的上层液体,加入 ② 溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(5)完成上述实验:①_______________。②_______________。
(6)结合实验ii和实验iii的现象,可得出的结论是_______________。
(7)实验iii的实验目的是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com