
【题目】工业上测量SO2、N2、O2混合气体中SO2含量的装置如右图。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2 +2H2O==H2SO4+2HI
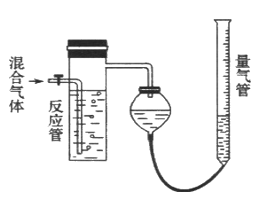
(1)混合气体进入反应管后,量气管内增加的水的体积等于__________的体积(填分子式)。
(2)反应管内的溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_____(填“偏高”、“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用_______________代替(填写物质名称)。
(4)若碘溶液体积为V![]() mL,浓度为cmol·L
mL,浓度为cmol·L![]() 。N2与O2的体积为V
。N2与O2的体积为V![]() mL(已折算为标准状况下的体积)。用c、V
mL(已折算为标准状况下的体积)。用c、V![]() 、V
、V![]() 表示SO2的体积百分含量为:_________________。
表示SO2的体积百分含量为:_________________。
(5)将上述装置改为简易实验装置,除导管外,还需选的仪器为________(选下列仪器编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
【答案】 N2、O2 偏低 酸性高锰酸钾溶液或溴水 V(SO2)%=![]() ×100% b、c、e、g或b、e、g或c、e、g
×100% b、c、e、g或b、e、g或c、e、g
【解析】(1)混合气体进入反应管中,其中SO2与I2发生反应:SO2+I2+2H2O=H2SO4+2HI不产生气体,剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积;
(2)根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)= 式中V(SO2)的量是由n(I2)的物质的量决定的,而“没有及时停止通气”就会使得V(混合气体)增大,则φ(SO2)偏低;
式中V(SO2)的量是由n(I2)的物质的量决定的,而“没有及时停止通气”就会使得V(混合气体)增大,则φ(SO2)偏低;
(3)反应管内的碘的淀粉溶液可以用能吸收SO2的有色溶液代替,中学常见且可用的是溴水(或溴的四氯化碳溶液)或高锰酸钾酸性溶液,因为紫红色高锰酸钾的溶液通入二氧化硫时会发生5SO2+2H2O+KMnO4═K2SO4+2H2SO4+2MnSO4(无色溶液)的反应,溶液现象由紫红色变成无色,溴水(或溴的四氯化碳溶液)发生SO2+Br2+2H2O═H2SO4+2HBr,变成无色,所以也可采用高锰酸钾溶液代替碘的淀粉溶液完成该实验;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量Va×10-3L×c molL-1=Vac×10-3mol,其体积为V(SO2)=Vac×10-3mol×22400 mLmol-1=22.4Vac mL,所以SO2的体积百分含量为:22.4VacmL÷[22.4c Va mL+Vb mL)]×100%=![]() ×100%,即SO2的百分含量为
×100%,即SO2的百分含量为![]() ×100%;
×100%;
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器试管、广口瓶、量筒、双孔塞,或是试管、量筒、双孔塞,故答案为bceg或beg。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.氯化氢溶于水能导电,所以盐酸是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g) ![]() W (s) +3H2O (g) 请回答下列问题:
W (s) +3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为;随着温度的升高,H2与水蒸气的体积比减小,则该反应为反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g) ![]() W(s)+2H2O (g) H=+66.0 kJmol1
W(s)+2H2O (g) H=+66.0 kJmol1
WO2(g)+2H2(g) ![]() W(s)+2H2O (g) H=-137.9 kJmol1
W(s)+2H2O (g) H=-137.9 kJmol1
则WO2(s) ![]() WO2(g)的 H=。
WO2(g)的 H=。
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) ![]() WI4 (g)。下列说法正确的有。
WI4 (g)。下列说法正确的有。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
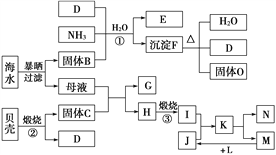
结合上述工艺流程图回答下列问题:
(1)物质G和L的化学式分别为________和________________。
(2)上述工艺流程图中可以循环使用的物质的化学式为______。
(3)反应①的化学方程式为______________________________;在反应①中必须先通入NH3,而后通入D,其原因是____________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为________________。
(5)由K溶液经如何处理才能制得N?_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是( )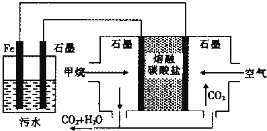
A.铁电极的电极反应式为:Fe-2e-═Fe2+
B.通人空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO![]()
C.若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5mol
D.为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是形成单质及其化合物种类最多的元素.回答下列有关问题.
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图(如图1) 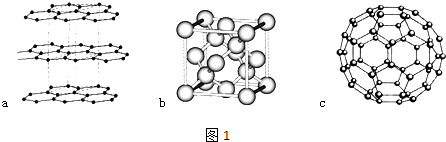
观察上述结构,判断a中碳原子的杂化方式为 , b对应的物质是 , c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 .
(2)在C60单质中,微粒之间的作用力为 , C60能与金属钾化合生成具有超导性的K3C60 , 在K3C60中阴阳离子个数比为1:3,则K3C60属于晶体.
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为;写出另一与CO互为等电子体的化学式 .
(4)CO可以和很多过渡金属形成配合物.金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4 , 用配位键表示Ni(CO)4 的结构为;写出基态Ni原子的电子排布式 .
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图2,则该化合物的化学式为; C、Ni、Mg三种元素中,电负性最大的是 . 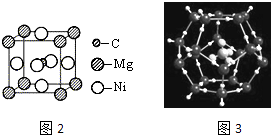
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源.可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如图3所示).两种分子中,共价键的键能;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com