
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。

(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点表示当加入_______ mol NaOH时,Al3+已经______,Mg2+已经___________。
(4)图中线段OA∶AB=____________。
【答案】Al3++ 3 OH- === Al(OH)3↓、Mg2++ 2 OH- === Mg(OH)2↓ Al(OH)3+ OH- === AlO2- +2H2O 2∶1 0.8 全部生成NaAlO2 完全生成沉淀Mg(OH)2 7∶1
【解析】
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液,先生成氢氧化铝、氢氧化镁沉淀,再加氢氧化钠,氢氧化铝又逐渐溶解。
⑴OD段是镁离子和铝离子沉淀的阶段,离子方程式为Al3++ 3 OH- === Al(OH)3↓、Mg2++ 2 OH- === Mg(OH)2↓,故答案为:Al3++ 3 OH- === Al(OH)3↓、Mg2++ 2 OH- === Mg(OH)2↓。
CD段是氢氧化铝溶解在氢氧化钠溶液中,离子方程式为Al(OH)3+ OH- === AlO2- +2H2O,故答案为:Al(OH)3+ OH- === AlO2- +2H2O。
(2)通过图像分析,n[Al(OH)3]:n[Mg(OH)2]=1:2,根据元素守恒,原溶液中Mg2+、Al3+的物质的量浓度之比为2:1,故答案为:2:1。
(3)根据图像分析得出图中C点氢氧化铝全部溶解,Al3+全部生成NaAlO2,Mg2+完全生成沉淀Mg(OH)2,C点加入NaOH的物质的量为n(NaOH) = 4n(Al3+)+2n(Mg2+)=4×0.1 mol+2×0.2mol = 0.8 mol,故答案为:0.8;全部生成NaAlO2;完全生成沉淀Mg(OH)2;
(4)根据上题分析得出AB阶段消耗0.8molNaOH,OA阶段消耗氢氧化钠物质的量n(NaOH) = 3n(Al3+)+2n(Mg2+)=3×0.1 mol+2×0.2mol = 0.7 mol,图中线段OA∶AB=7:8,故答案为:7:8。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为___________________。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
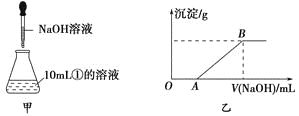
①OA段反应的离子方程式为_____________________。
②AB段反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.80g含氧化镁的镁条完全溶于50.0mL硫酸溶液后,滴加2.00mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去氢氧化钠溶液200.0mL。将所得的沉淀灼烧、冷却后称量得固体质量为4.40g。
已知:Mg(OH)2在灼烧过程中发生如下反应Mg(OH)2![]() MgO+H2O
MgO+H2O
请计算:
(1)用去的氢氧化钠溶液中含溶质的物质的量n(NaOH)=_______mol。(结果保留小数点后两位有效数字)
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.标准状况下,11.2 L CCl4中含有分子的数目为0.5NA
C.2 L 0.5 mol· L-1硫酸钾溶液中阴离子所带电荷数为NA
D.标准状况下,22.4 L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中滴加过量NH3·H2O:Al3+ + 4OH-= AlO2-+ 2H2O
B. 钠与水的反应:Na+2 H2O =Na++2OH-+H2↑
C. NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓
D. 氯气与水的反应:Cl2 + H2O = 2 H+ + ClO-+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
回答下列问题:
(1)芳香烃R分子的官能团是_________(填官能团符号),R的最简单同系物是_____(填化学名称)。
(2)反应②的化学方程式为__________________。
(3)③和⑦的反应类型分别属于____________、______________________。
(4)高聚物J的结构简式为________________________。
(5)反应⑥的反应条件是______________________。
(6)H与T互为同分异构体,符合下列性质特征的H分子共有________种。
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
(7)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):____________________________________________________。
的合成路线(无机试剂任选):____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法错误的是
),其原理如图所示,下列说法错误的是
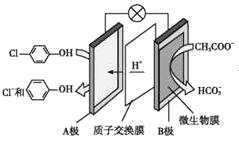
A.该方法能够提供电能
B.B极上的电势比A极上的电势低
C.A极的电极反应为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]()
D.电池工作时H+通过质子交换膜由正极区向负极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com