
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
【答案】铁 6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3和Fe(OH)3 2CrO42-+2H+
12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3和Fe(OH)3 2CrO42-+2H+![]() Cr2O72-+H2O > 加热浓缩 冷却结晶 研钵 3
Cr2O72-+H2O > 加热浓缩 冷却结晶 研钵 3
【解析】
(1)高温下陶瓷或玻璃中的SiO2会与NaOH及Na2CO3发生反应;由流程中的产物及已知条件,根据质量守恒写出反应方程式。
(2)第一次过滤的滤渣为熔渣中的Fe2O3以及反应NaFeO2+2H2O=Fe(OH)3+NaOH生成的Fe(OH)3。
(3)酸化时,CrO42-→Cr2O72-,由此写出离子方程式。
(4)步骤③利用了复分解反应将溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7沉淀。
(5)依据溶解度曲线,采用蒸发浓缩、冷却结晶,过滤并洗涤沉淀的方法进行分离。
(6)实验室研磨固体时,所用硅酸盐质仪器为研钵。
(7)K[Cr(C2O4)2]·nH2O的相对分子质量为267+18n,失掉全部结晶水,失重16.8%,即结晶水的质量分数为16.8%,列式计算。
(1)高温下陶瓷或玻璃中的SiO2会与NaOH及Na2CO3发生反应;由流程中的产物及已知条件可知反应方程式为6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑。
12Na2CrO4+3Fe2O3+7KCl+12CO2↑。
(2)第一次过滤的滤渣为熔渣中的Fe2O3以及反应NaFeO2+2H2O=Fe(OH)3+NaOH生成的Fe(OH)3。
(3)酸化时,CrO42-→Cr2O72-,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(4)步骤③利用了复分解反应Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,将溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7沉淀。
(5)依据溶解度曲线,采用蒸发浓缩、冷却结晶,过滤并洗涤沉淀的方法进行分离。
(6)实验室研磨固体时,所用硅酸盐质仪器为研钵。
(7)K[Cr(C2O4)2]·nH2O的相对分子质量为267+18n,由题意知![]() ,解得:n=3。
,解得:n=3。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
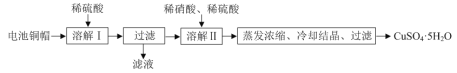
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol/L的盐酸配制成250mL0.1mol/L的盐酸溶液。
(1)计算所需2mol/L的盐酸的体积是_____________。
(2)在容量瓶的使用方法中,下列操作正确的是_______________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度_________。(填“偏高”;“偏低”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
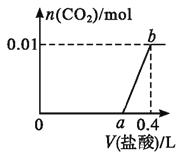
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
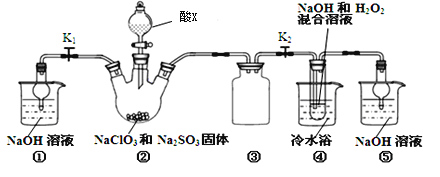
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环乙二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
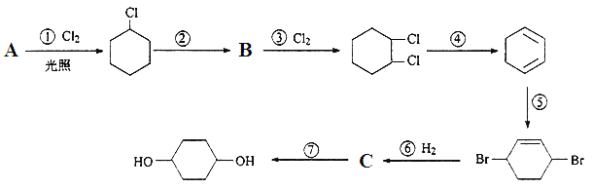
1,4-环乙二醇
(1)A的结构简式是___________________________。
(2)反应②应所需的试剂和条件是_______________________________。
(3)写出反应④、⑦的化学方程式:
④____________________________________________;
⑦_________________________________________。
(4)①的反应类型是_________,②的反应类型是_________,上述七个反应中属于加成反应的有_________(填反应序号),
(5)反应⑤中可能产生一定量的有机副产物,其可能的结构简式为________________________。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O ![]() Cl- +ClO- +2H+
Cl- +ClO- +2H+
D. 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
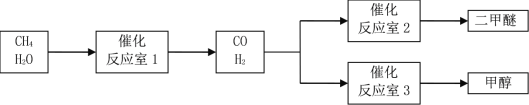
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
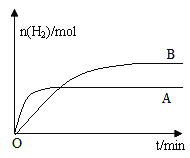
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
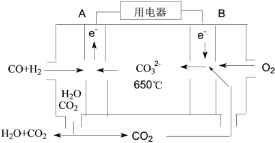
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。

(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点表示当加入_______ mol NaOH时,Al3+已经______,Mg2+已经___________。
(4)图中线段OA∶AB=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com