
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的工艺流程如下:

已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。
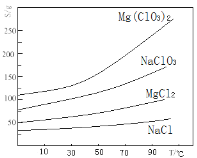
(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;② ;③ ;④过滤、洗涤。
(3)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。此过程中反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定步骤2中多余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4: ,平均消耗K2Cr2O7 溶液15.00 mL。
①题中所用FeSO4溶液中,常加入适量稀硫酸和铁粉以抑制其变质。其中,加稀硫酸的作用是(用离子方程式解释): 。
②步骤4中空缺的内容为 。
③产品中Mg(ClO3)2·6H2O(摩尔质量为299g/mol)的质量分数为 。
【答案】(1)漏斗、玻璃棒、烧杯(3分)BaSO4和Fe(OH)3(2分)
(2)①蒸发结晶②趁热过滤③冷却结晶(3分)
(3)①Fe2++2H2O![]() Fe(OH)2+2H+(2分)
Fe(OH)2+2H+(2分)
②将步骤2、3重复操作2~3次(2分)③78.3%(2分)
【解析】
试题分析:(1)过滤所需要的主要玻璃仪器有漏斗、玻璃棒、烧杯;滴加BaCl2溶液时可生成BaSO4沉淀,加MgO调节溶液pH的目的是促进Fe3+水解生成Fe(OH)3,则过滤所得滤渣的主要成分为BaSO4和Fe(OH)3;
(2)根据物质的溶解度大小,溶液获得晶体的方法是:将反应后的溶液进行蒸发结晶、趁热过滤除去NaCl,再将滤液冷却结晶,最后过滤、洗涤即可得到Mg(ClO3)2·6H2O;
(3)①配制FeSO4溶液时常加入适量稀硫酸和铁粉以抑制其变质,加稀硫酸的作用是抑制Fe2+的水解,水解反应式为Fe2++2H2O ![]() Fe(OH)2+2H+;
Fe(OH)2+2H+;
②不提高测量的准确性,通常会将步骤2、3重复操作2~3次,取平均值进行计算;
③根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100molL-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20 × 10-3L × 1.000molL-1-0.009mol=0.011mol,氯酸根离子的物质的量为:1/6 × 0.011mol,产品中Mg(ClO3)26H2O的质量分数:(1/2 × 0.011 × 299g/mol) × 10 × 1/3.5 × 100%=78.3%。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下图表示反应A(g)+B(g)![]() n C(g);(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
n C(g);(正反应为放热反应),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )

A. 反应由逆反应开始
B. a表示有催化剂,b表示无催化剂
C. 若n=2,其它条件相同,a比b的压强大
D. 若其它条件相同,a比b的温度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示。下列说法正确的是

A. 化学能转变为电能
B. 阴极的电极反应为:CO2+4e-=C↓+2O2-
C. 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑
D. 阴极上每通过4mole-,阴极区有1molCO2参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣服的汗渍、血液及人体排放的蛋白质油渍遇到它,皆能水解除去,下列衣料中不能用加酶洗衣粉洗涤的是( )
①棉织品 ②毛织品
③腈纶织品 ④蚕丝织品
⑤涤纶织品 ⑥锦纶织品
A. ①②③④⑤⑥ B. ②④
C. ③④⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能说明微量元素是生命活动所必需的
A. Mg是叶绿素不可缺少组成成分 B. 人体内K+含量过少会出现低钾症
C. 哺乳动物血液中Ca2+盐含量太低会抽搐 D. 人体内Fe2+的含量过低会导致贫血
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21mol
B.0.25mol
C.0.3mol
D.0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家侯德榜发明的联合制碱法(又称侯氏制碱法)主要原理是:向饱和食盐水中先后通入足量NH3和CO2,生成NaHCO3(在该混合溶液中溶解度较小),加热可得到Na2CO3。某化学小组利用如图装置进行模拟实验,A、B、C、D为备选装置。
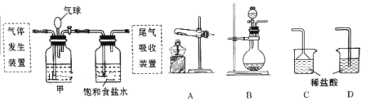
请填写下列空白:
(1)联合制碱法制取NaHCO3的化学方程式为。
(2)用石灰石和盐酸制取CO2时应选用的气体发生装置为(填字母代号,下同),该反应的离子方程式为;若制NH3选用与实验室制取CO2相同的发生装置,则应选择的试剂为(填试剂的名称)。
(3)按照如图所示的装置制备NH3,并充入NH3来制备饱和氨盐水,应选用的尾气吸收装置为(填字母代号);甲装置的作用为;该实验过程中应先通入后通入,其原因是。
(4)反应一段时间后,饱和氨盐水中析出NaHCO3晶体,从中得到纯净NaHCO3并进一步制得Na2CO3的操作名称依次是、。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com